El entrenamiento interválico aeróbico semisupervisado mejora la capacidad cardiorrespiratoria en adultos sedentarios con factores de riesgo cardiometabólico
*Correspondencia: Leonardo Machado leonardoed.fisica@hotmail.com
Citación
Ensenyat, A., Machado, L., Matas, S. & Blanco, A. (2023). Semi-supervised aerobic interval training improves cardiorespiratory fitness in sedentary adults with cardiometabolic risk factors.Apunts Educación Física y Deportes, 154, 1-15. https://doi.org/10.5672/apunts.2014-0983.es.(2023/4).154.01
Resumen
El objetivo de este estudio fue evaluar los efectos de un programa de ejercicio de alta intensidad semisupervisado junto con asesoramiento sobre hábitos adecuados para la adaptación cardiorrespiratoria al esfuerzo en adultos sedentarios con factores de riesgo cardiometabólico. Ensayo clínico controlado aleatorizado de tres grupos de cuarenta semanas de duración (intervención de 16 semanas y seguimiento a las 24 semanas). Se asignó a adultos sedentarios (23 hombres, 38 mujeres) con edades comprendidas entre los 34 y los 52 años (M = 44.6, DT = 4.6), y al menos un factor de riesgo cardiometabólico, a uno de los siguientes grupos: (1) entrenamiento interválico aeróbico (EIA) más asesoramiento sobre hábitos adecuados; (2) entrenamiento continuo de intensidad entre baja y moderada más asesoramiento sobre hábitos adecuados (ECT, de “entrenamiento continuo tradicional”); o (3) solo asesoramiento sobre hábitos adecuados (AHA). La capacidad cardiorrespiratoria, en cuanto a consumo de oxígeno pico (VO2pico) y consumo de oxígeno en el punto de compensación respiratoria (VO2PCR), el índice de eficiencia ventilatoria (pendiente de VE-VCO2) y la pendiente de eficiencia del consumo de oxígeno (PECO) se evaluaron al inicio, después de la intervención y en el seguimiento. Todos los programas de intervención generaron cambios significativos comparables en la capacidad cardiorrespiratoria, pero los cambios en VO2pico difirieron en función de si los participantes alcanzaron o no los criterios máximos al inicio del estudio. La intervención fue más eficaz para los participantes que no alcanzaron los criterios máximos al inicio del estudio que para los que sí los alcanzaron. En los participantes que no alcanzaron los criterios máximos al inicio del estudio, VO2pico aumentó significativamente. Todos los programas de intervención generaron aumentos comparables significativos pero no persistentes de VO2UV, ningún cambio en la pendiente de VE-VCO2 y mejorías persistentes de la PECO. La intervención semisupervisada de EIA tuvo efectos positivos sobre la adaptación fisiológica al esfuerzo y la capacidad cardiorrespiratoria, pero no difirió sustancialmente del ECT ni del AHA.
Introducción
El síndrome metabólico (SM), un conjunto de factores de riesgo cardiometabólico, tiene un fuerte efecto negativo sobre la salud cardiovascular y la muerte prematura (Gami et al., 2007). Los datos fácticos epidemiológicos indican que los hábitos poco saludables están estrechamente relacionados con la creciente prevalencia del SM y otras enfermedades no transmisibles en todo el mundo (OMS, 2018). Se ha demostrado que el cambio de hábitos genera resultados positivos en la prevención y el control del riesgo cardiometabólico (Pattyn et al., 2013).
La actividad física se considera un pilar de un estilo de vida saludable y están bien demostrados los beneficios para la salud del ejercicio de intensidad moderada (Pedersen y Saltin, 2015). Sin embargo, desde hace unos años, existe un interés cada vez mayor por el entrenamiento interválico de alta intensidad (EIAI), en particular por el entrenamiento interválico aeróbico (EIA), en entornos sanitarios extraacadémicos (Pattyn et al., 2013). Los datos fácticos actuales han revelado el potencial del EIA como valiosa estrategia para reducir la prevalencia de los factores de riesgo cardiometabólico (Tjønna et al., 2018).
El nivel de capacidad cardiorrespiratoria (CCR) también se ha identificado como un factor de predicción independiente y eficaz de la mortalidad (Lee et al., 2010; Myers et al., 2015). En una revisión sistemática reciente, Lee (2020) informó de que, independientemente del estado de obesidad, una CCR baja se relacionaba con un riesgo de síndrome metabólico 3.59 veces mayor, mientras que una CCR alta lo disminuía en un 77 %. Según Knaeps et al. (2018), es probable que una combinación de disminución del sedentarismo (S) y aumento de la actividad física entre moderada y vigorosa (AFMV), que influya positivamente en la CCR, sea lo más beneficioso para la salud cardiaca y metabólica.
La CCR se evalúa habitualmente mediante el consumo de oxígeno pico (VO2pico) medido durante una prueba de esfuerzo cardiopulmonar (PECP). Un aumento de VO2pico de 3.5 ml/kg/min (1-EM: equivalente metabólico) se traduce en una mejor supervivencia de entre el 10 % y el 25 % en ambos sexos (Myers et al., 2015). Se ha informado de que la reducción de la mortalidad puede ser aún mayor (un 30 % por aumento de 1-EM) en personas con baja forma física (<5 EM de capacidad funcional) y cardiopatía que participan en programas de rehabilitación cardiaca (Myers et al., 2015).
El EIA ha demostrado sistemáticamente mejores resultados que el entrenamiento continuo tradicional (ECT) a la hora de mejorar el VO2pico (Pattyn et al., 2014; Wisløff et al., 2007). Dado que un VO2pico bajo está relacionado con la mortalidad prematura y el riesgo cardiovascular (Lee, 2020; Myers et al., 2015), la capacidad potencial del EIA para mejorar este parámetro es, desde el punto de vista de la salud, un hallazgo prometedor.
Además del VO2pico, la PECP permite evaluar varios índices que son relativamente independientes del esfuerzo máximo, tales como el índice de eficiencia ventilatoria (pendiente de ventilación vs. producción de dióxido de carbono [pendiente de VE-VCO2]) y la pendiente de eficiencia del consumo de oxígeno (PECO) (Baba et al., 1996). Estos índices son mediciones integradas de la adaptación fisiológica al ejercicio. Tienen valor pronóstico, son sensibles al cambio y relevantes para evaluar la progresión de la capacidad de ejercicio en pacientes con cardiopatía o miopatía mitocondrial (Akkerman et al., 2010). Hasta donde sabemos, existen pocos estudios que evalúen los efectos de las intervenciones de EIAI sobre estos índices en personas con síndrome metabólico (Guio de Prada et al., 2019a).
Como último concepto, aunque la eficacia del EIA para generar mejorías fisiológicas en un entorno de investigación bien controlado ya no está en duda, sigue habiendo interrogantes sobre hasta qué punto sus beneficios son transferibles a un entorno clínico menos controlado (eficacia). Los datos fácticos sobre la eficacia de las intervenciones de fomento de la actividad física son contradictorios, ya que con frecuencia los programas de ejercicio presentan grandes tasas de abandono al cabo de unas semanas o meses. Además, la mayoría de los estudios se han centrado en la eficacia a corto plazo, pero no han informado de la persistencia de los efectos. Sin embargo, para lograr resultados duraderos y satisfactorios, estos programas deben incluir medidas que ayuden a las personas a potenciar su autoeficacia, mejorando la alfabetización y proporcionando herramientas de autocontrol (OMS, 2018). En este sentido, nuestro estudio analiza los efectos a corto y medio plazo e incluye una intervención de asesoramiento sobre hábitos adecuados que incorpora estrategias para fomentar la actividad física regular, minimizar el sedentarismo, mejorar los hábitos dietéticos y potenciar la autoeficacia de los participantes.
El objetivo principal del presente estudio era evaluar la eficacia de un programa de entrenamiento interválico aeróbico (EIA) semisupervisado junto con el asesoramiento sobre hábitos adecuados en la capacidad cardiorrespiratoria en cuanto a VO2pico, consumo de oxígeno en el punto de compensación respiratoria (VO2PCR), pendiente de VE-VCO2 y PECO en adultos sedentarios con factores de riesgo cardiometabólico. Esta intervención se comparó con el entrenamiento continuo de intensidad entre baja y moderada más asesoramiento sobre hábitos adecuados (ECT) y con solo el asesoramiento sobre hábitos adecuados (AHA). Se planteó la hipótesis de que el EIA mostraría mejores resultados en cuanto a mejoría de la CCR que el ECT o el AHA.
Materiales y metodología
Diseño
Se llevó a cabo un ensayo clínico controlado y aleatorizado de tres grupos (NCT02832453) en un entorno de atención primaria durante un periodo de 16 semanas, con un seguimiento a las 24 semanas. Incluyó dos grupos de ejercicio semisupervisados con diferentes niveles de intensidad de ejercicio (EIA y ECT), así como un grupo de control sin ejercicio (AHA) (Ensenyat et al., 2017, 2020).
Participantes
Inicialmente, el estudio incluyó a 75 (26 hombres, 49 mujeres) voluntarios sedentarios de entre 34 y 55 años. Los requisitos de admisión eran tener entre 30 y 55 años, pasar la mayor parte del tiempo de vigilia de forma sedentaria (sentados o tumbados) y presentar al menos un factor de riesgo cardiometabólico (perímetro de cintura >94.5 cm para los hombres, y >89.5 cm para las mujeres; presión arterial ≥130/ 85 mmHg; triglicéridos en plasma ≥150 mg/dl; HDL en plasma <40 mg/dl para los hombres y <50 mg/dl para las mujeres; glucosa en ayunas ≥100 mg/dl). Se excluyó a las personas con problemas de salud graves (obesidad mórbida, enfermedades cardiopulmonares importantes, trastornos neuromusculares o psiquiátricos) o enfermedades que pudieran contraindicar el ejercicio físico (Ensenyat et al., 2017, 2020).
Los participantes se reclutaron en centros de atención primaria y a través de anuncios en los medios de comunicación. Todos los participantes fueron plenamente informados de los procedimientos experimentales y dieron su consentimiento informado por escrito antes de inscribirse. A continuación, se les asignó aleatoriamente a uno de los grupos del estudio (EIA, ECT o AHA) (Figura 1).
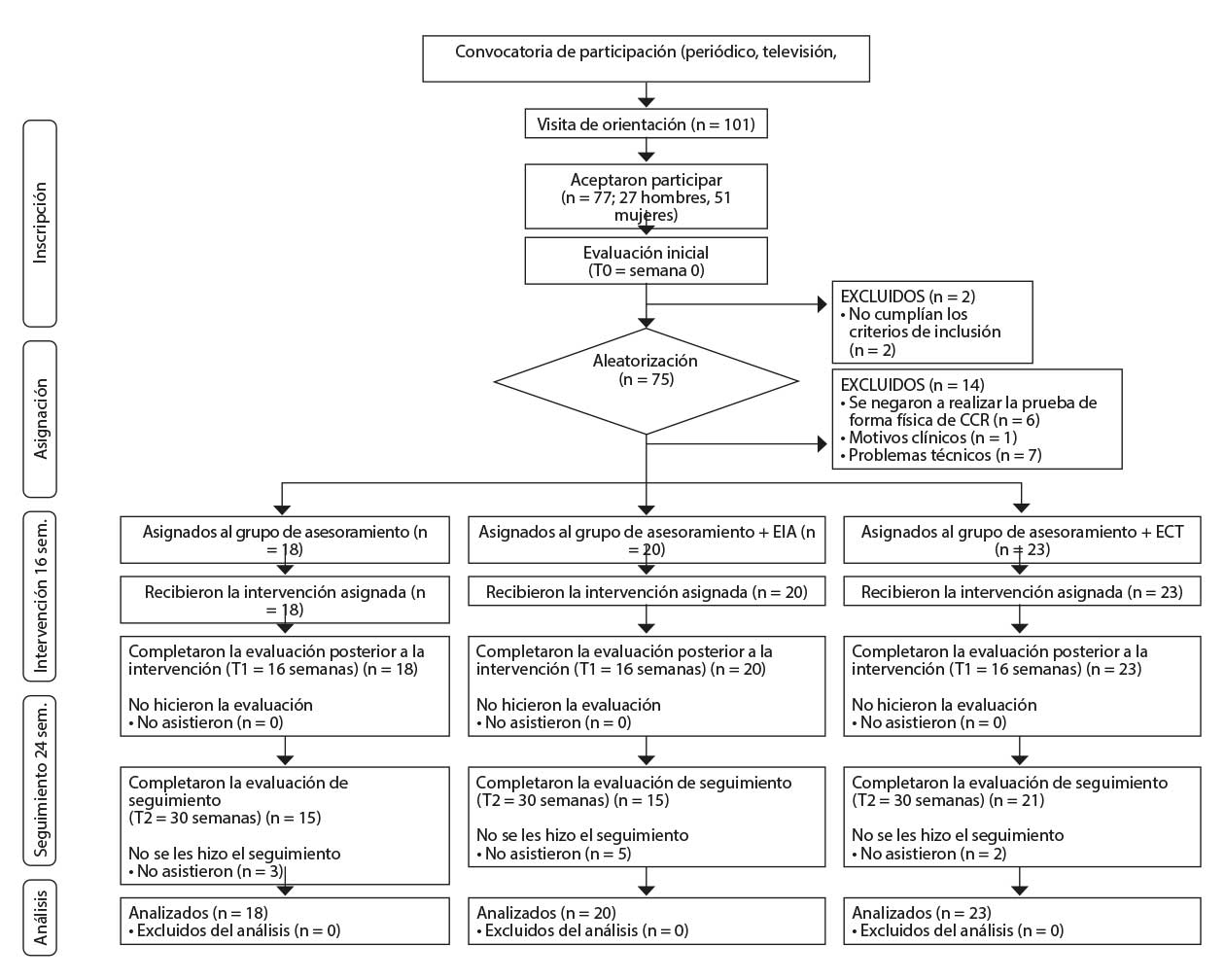
Nota: Se excluyen del organigrama de participantes los participantes incluidos en el ensayo Bellugat [Ensenyat, 2020 3078 /id] pero que no superaron la prueba de capacidad cardiorrespiratoria.
CCR: capacidad cardiorrespiratoria; EIA: grupo de estudio de entrenamiento interválico aeróbico; AHA: grupo de estudio de asesoramiento. ECT: grupo de estudio de entrenamiento continuo tradicional. T0: evaluación inicial; T1: evaluación de la intervención a las 16 semanas; T2: evaluación de seguimiento a las 24 semanas.
Los procedimientos del estudio fueron aprobados por el Comité Ético de Investigación Clínica del Instituto de Investigación en Atención Primaria Jordi Gol (IDIAP) (número de registro: P15/122) y se ajustaron a la Declaración de Helsinki (Cook et al., 2003). La metodología de estudio cumplió las directrices de CONSORT (Schulz et al., 2011).
Intervención
El ensayo comprendía una intervención de 16 semanas y un seguimiento a las 24 semanas. Durante la fase de intervención, se ofreció a todos los grupos asesoramiento sobre hábitos adecuados, que consistió en seis sesiones en grupo de 50 minutos y cuatro sesiones individuales de 40-50 minutos cada una (Ensenyat et al., 2017). Los dos grupos de ejercicio (EIA y ECT) también emprendieron un programa de ejercicio físico semisupervisado. Este programa consistió en 16 sesiones de entrenamiento en grupo supervisadas de 50 minutos de duración cada una y 32 sesiones individuales sin supervisión. La frecuencia de las sesiones supervisadas fue disminuyendo a lo largo de la intervención, mientras iba aumentando la frecuencia de las sesiones individuales sin supervisión. Todas las sesiones de entrenamiento constaron de cinco partes: introducción, calentamiento, parte principal (véase más abajo), vuelta a la calma y conclusión. La parte principal difería entre los grupos de EIA y de ECT. Las sesiones de EIA consistieron en cuatro repeticiones de 4 minutos al 80 % del VO2pico, alternadas con pausas activas de 2 minutos al 60 % del VO2pico y duraron un total de 24 minutos de tiempo de ejercicio efectivo, mientras que las sesiones de ECT consistieron en 40 minutos de actividades de intensidad moderada (60 % del VO2pico).
No se notificaron molestias ni incidencias. La asistencia media a las sesiones de ejercicio supervisado y a las sesiones de asesoramiento grupal e individual fue del 71.9 % (DT = 20.2), 83.1 % (DT = 17.1) y 98.8 % (DT = 5.4) de las sesiones ofrecidas, respectivamente. No hubo diferencias entre los grupos de estudio ni entre sexos.
Medición de los resultados
Las mediciones de los resultados se registraron al inicio (T0 = semana 0), después de la intervención (T1 = semana 16) y tras el seguimiento a las 24 semanas (T2 = semana 40).
Prueba de ejercicio cardiorrespiratorio graduado
Los participantes completaron una prueba voluntaria de ejercicio máximo graduado en un cicloergómetro (Monark 828E, Monark, Suecia). Tras una fase de calentamiento de dos minutos a 10 W, la carga de trabajo aumentó 20 W cada dos minutos hasta que los participantes fueron incapaces de mantener la cadencia preestablecida (60 r. p. m.) o si se observaban respuestas anómalas (Balady et al., 2010).
Durante la prueba, se midieron variables ergoespirométricas utilizando el sistema metabólico Oxycon Mobile (Oxycon Mobile, Carefusion, Alemania). Se efectuaron calibraciones de gas antes de cada prueba. La frecuencia cardiaca se midió con un pulsómetro de pecho Polar 610s (Polar Electro YO, Kempele, Finlandia). La tensión arterial se tomó 30 segundos antes de la finalización de cada etapa utilizando un tensiómetro automático para la parte superior del brazo (Omron M, Omron Healthcare Europe B.V. Hoofddorp, Países Bajos). Antes de finalizar la fase, los participantes comunicaron su percepción subjetiva del ejercicio utilizando la escala CR-10 de Borg (Borg y Kaijser, 2006). La cronotropía superior al 85 % (Balady et al., 2010) y la tasa de intercambio respiratorio (TIR) > 1.1 se utilizaron como criterios para haber alcanzado el esfuerzo máximo.
La obtención de datos se llevó a cabo en una sala de laboratorio bien ventilada. Se indicó a los participantes que ayunaran y evitaran el consumo de cafeína durante las dos horas previas a la prueba, y se les pidió que evitaran todo ejercicio extenuante el día anterior a la prueba.
Medidas máximas
Se comunicaron los datos ergoespirométricos máximos (pico) de carga de trabajo (CT), consumo de oxígeno (VO2), producción de dióxido (VCO2), ventilación (VE), frecuencia cardiaca (FC), presión arterial (presión arterial sistólica [PAS]), presión arterial diastólica [PAD] y presión arterial media [PAM]).
Medidas independientes del esfuerzo
Para evaluar la capacidad de ejercicio submáxima, se obtuvo el punto de compensación respiratoria (PCR) mediante un aumento concomitante de ambos equivalentes ventilatorios (VE-VO2 y VE-VCO2) y una disminución de la presión parcial de CO2 (PETCO2) tras una meseta (Beaver et al., 1986). Dos observadores calcularon este punto de forma independiente y lo corroboraron con posterioridad.
La pendiente de la eficiencia ventilatoria se obtuvo mediante un análisis de regresión lineal de la relación entre la ventilación (VE) y la producción de dióxido de carbono (VCO2) con todos los datos del ejercicio (Arena et al., 2003). La pendiente de la eficiencia del consumo de oxígeno (PECO) se calculó con todos los datos del ejercicio según Baba et al. (1996) llevando a cabo un análisis de regresión lineal de la relación entre VO2 y el logaritmo de VE (VO2 = alog10VE + b).
Indicadores de riesgo cardiometabólico y hábitos
Se calculó una puntuación de gravedad del síndrome metabólico (PGSM) continua, según lo descrito por Wiley y Carrington (2016). La puntuación contiene seis factores de riesgo: perímetro de cintura (PC), concentración de triglicéridos (CT), concentración de colesterol de lipoproteínas de alta densidad (HDL, por sus siglas en inglés), glucemia, presión arterial sistólica (PAS) y presión arterial diastólica (PAD). El PC se midió por triplicado siguiendo las directrices de la OMS (2011). Las muestras de sangre para determinar las cifras de CT, HDL y glucosa se obtuvieron tras un ayuno nocturno y se analizaron con métodos automatizados en el hospital universitario. La presión arterial (PA) se midió a nivel de la arteria braquial del brazo dominante utilizando un dispositivo automatizado (Omron M, Omron Healthcare Europe B.V. Hoofddorp, Países Bajos), con el participante en posición sentada relajada.
El comportamiento activo y el sedentarismo se evaluaron objetivamente utilizando el acelerómetro ActiGraph GT3X+ (ActiGraph LLC, Pensacola, FL, EE. UU.) durante siete días consecutivos. Los datos de los acelerómetros se descargaron y analizaron con el programa informático ActiLife 6.0 (ActiGraph, Pensacola, FL, EE. UU.). Se excluyeron del análisis las horas de sueño. Se analizaron los datos para obtener un índice global de actividad física (número de pasos diarios y como magnitud vectorial [MV] en recuentos medios por minuto [RMM]) y el porcentaje de tiempo dedicado a realizar diferentes niveles de actividad física (Troiano et al., 2008).
Se completó un registro dietético de 24 horas durante tres días (dos entre semana y uno en fin de semana) para controlar los hábitos alimentarios de cada participante. Para analizar los registros dietéticos, se utilizó el programa informático PCN-CSNIS 1.0. Se calculó el índice de alimentación saludable (IAS) para evaluar el estado dietético de los participantes (Basiotis et al., 2002).
Métodos estadísticos
Para determinar el tamaño de la muestra de este estudio, se llevó a cabo un análisis de potencia con G*Power 3.1. (Faul et al., 2007) y los resultados obtenidos por Tjonna et al. (2008) en una intervención supervisada de ejercicio físico dirigida a personas con síndrome metabólico. Con el fin de detectar los cambios esperados con una hipótesis bilateral, un tamaño del efecto esperado de d = .46, un α de riesgo de .05, una potencia del 80 % y mediciones repetidas en 3 ocasiones y 3 grupos de estudio; el número estimado de participantes fue de 48; 16 personas por grupo de estudio. La muestra actual de 62 personas se consideró suficiente para evaluar las hipótesis planteadas en relación con la CCR.
Se comprobó la normalidad de los datos y, a continuación, se utilizaron las pruebas de ji-cuadrado (χ²) y Kruskal-Wallis (K-W) para comparar los grupos del estudio al inicio (T0). Asimismo, se realizó un análisis por intención de tratar a todos los participantes que completaron la prueba de ejercicio graduado al inicio del estudio. Se establecieron dos marcos temporales: eficacia (al final de la intervención; T1) y persistencia (en el seguimiento a las 24 semanas; T2). Se utilizaron las pruebas de Wilcoxon y Kruskal-Wallis para analizar las diferencias entre los grupos de estudio y los cambios a lo largo del tiempo. Las variables continuas se expresan como media y desviación típica (DT). Por su parte, las variables categóricas se expresan como recuentos (n) y porcentajes (%), a menos que se especifique lo contrario.
Se empleó la correlación de Pearson (r) para evaluar las asociaciones entre las variables cuantitativas.
La significación se fijó en p < .05. Para todos los análisis, se utilizó SPSS 17.0 (SPSS, Chicago, IL, EE. UU.).
Resultados
Participantes
61 participantes (23 hombres y 38 mujeres) de edades comprendidas entre los 34 y los 52 años (M = 44.6; DT = 4.6) superaron la prueba inicial de ejercicio graduado (Figura 1). No hubo diferencias entre los grupos del estudio en cuanto a actividad física, hábitos dietéticos u otros factores de riesgo cardiometabólico al inicio del estudio.
Resultados en materia de riesgo cardiometabólico y hábitos
Se observó un efecto temporal significativo para PGSM sin efecto grupal (Tabla 1). Se observó una pequeña disminución significativa de la puntuación de PGSM tras la intervención. Los cambios persistieron durante el seguimiento: el 34.4 % y el 35.7 % de los participantes redujeron su puntuación de PGSM en al menos 0.5 puntos en T1 y T2. Los efectos fueron similares en todos los grupos del estudio.
Los participantes llevaron el acelerómetro durante 6.98 (DT = 0.6) días y 820.9 (DT = 7) minutos al día. Se observó un efecto temporal significativo para pasos/día, actividad global, tiempo sedentario, AFMV e IAS sin efecto grupal (Tabla 1).

Tabla 1
Puntuación de riesgo de síndrome metabólico y medidas en cuestión de hábitos al inicio (T0), después de la intervención (T1) y en el seguimiento a las 24 semanas (T2) (n = 61).
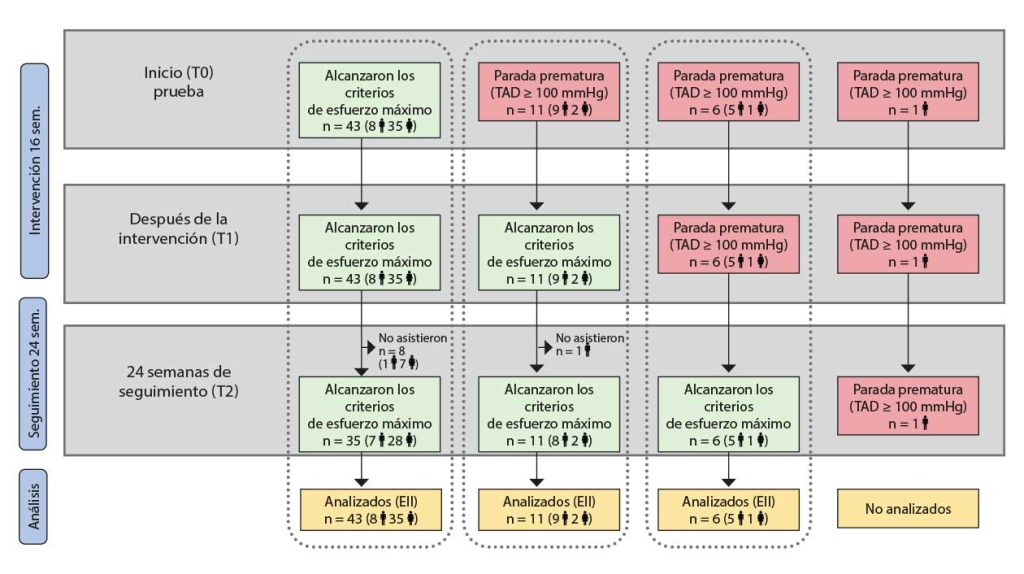
Nota: El supuesto A corresponde a los participantes que alcanzaron los criterios máximos para la prueba de CCR en T0, T1 y T2; el supuesto B corresponde a los participantes que finalizaron la prueba de CCR debido a una respuesta de hipertensión arterial en T0, pero que alcanzaron los criterios máximos para la prueba de CCR en T1 y T2; el supuesto C corresponde a los participantes que finalizaron la prueba de CCR debido a una respuesta de hipertensión arterial en T0 y T1, pero que alcanzaron los criterios máximos para la prueba de CCR en T2. CCR: capacidad cardiorrespiratoria; PAD: presión arterial diastólica; T0: evaluación inicial; T1: tras la evaluación de la intervención de 16 semanas; T2 en la evaluación de seguimiento a las 24 semanas.
Prueba de ejercicio cardiorrespiratorio graduado
Sesenta y un participantes completaron la evaluación inicial mediante pruebas cardiorrespiratorias. Cuarenta y tres (70.5 %) participantes la superaron y alcanzaron los criterios de esfuerzo máximo. Tal y como muestra la Figura 2, estos participantes también alcanzaron los niveles de esfuerzo máximo en T1 y T2 (supuesto A). Los otros 18 participantes (29.5 %) tuvieron que abandonar la prueba inicial debido a una respuesta anormal de la tensión arterial. (supuesto B y supuesto C). No hubo diferencias entre los grupos de estudio en cuanto a los motivos para abandonar la prueba cardiorrespiratoria (χ² = 1.431, p = .489).
Consideramos que no es posible analizar los datos de los valores máximos con todos los participantes/supuestos en una misma categoría. Por ello, hemos dividido el análisis de VO2pico en tres supuestos (Tabla 2). Los datos independientes del esfuerzo se han analizado con todos los participantes en una misma categoría.

Tabla 2
Datos de las pruebas de capacidad cardiorrespiratoria al inicio (T0), después de la intervención (T1) y en el seguimiento a las 24 semanas (T2).
VO2pico
Supuesto A: Al inicio (T0), no hubo diferencias significativas entre los grupos de estudio en relación con los valores pico. La tasa de intercambio respiratorio pico (TIRpico) (M = 1.19, DT = 0.07), la cronotropía (M = 85.5 %, DT = 17.7) y los valores de Borg CR-10 (M = 7.8, DT = 1.8) sugieren un alto nivel de esfuerzo durante la prueba.
Se observó un efecto temporal significativo para la carga de trabajo máxima (CTpico) sin efecto grupal (Tabla 3a). A pesar de esta mejoría, el VO2pico no cambió tras la intervención ni en el seguimiento. Los aumentos medios del VO2pico tendieron a ser mejores en el grupo EIA, pero los cambios fueron inferiores al umbral clínico de 3.5 ml/kg/min (Figura 3). Sin embargo, el porcentaje de participantes que mejoraron su VO2pico por encima de este umbral fue mayor en el grupo EIA (36 %) que en los otros grupos (ECT = 28 %; AHA = 18 %). Durante el seguimiento, la mejoría persistió en el 28 % de los participantes del EIA, pero solo en el 5 % y el 18 % de los participantes de los grupos de ECT y el AHA.
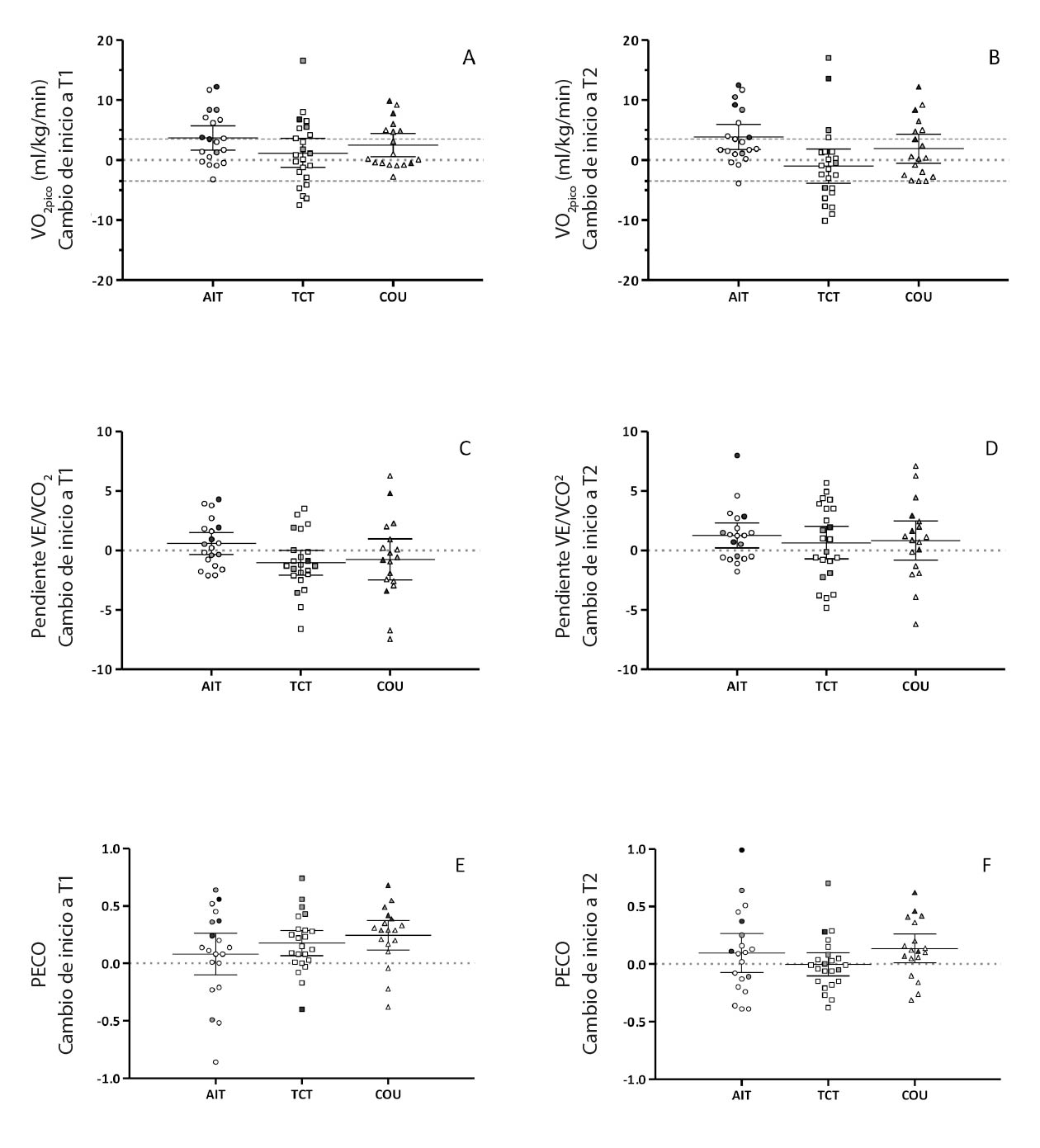
Nota: T1: evaluación tras la intervención de 16 semanas; T2: evaluación de seguimiento a las 24 semanas.
EIA: grupo de estudio que hizo entrenamiento interválico aeróbico; AHA: grupo de estudio que solo recibió asesoramiento; ECT: grupo de estudio que hizo entrenamiento continuo tradicional.
PECO: pendiente de la eficiencia del consumo de oxígeno; VCO2: producción de dióxido de carbono; VE: ventilación; VO2: consumo de oxígeno; UV: umbral ventilatorio; GP: generación de potencia.
Cada punto indica un participante individual.
Los símbolos claros indican el supuesto A; los símbolos grises indican el supuesto B, y los símbolos grises negros, el supuesto C.

Tabla 3a
Datos de las pruebas de capacidad cardiorrespiratoria al inicio (T0), después de la intervención (T1) y en el periodo de seguimiento de 24 semanas (T2) para el supuesto A (n = 43).
Supuesto B: Tal y como muestra la Figura 2, once participantes tuvieron que abandonar la prueba inicial (valores de TIRpico [M = 1.02, DT = 0.11], cronotropía [M = 60.8 %, DT = 21.4], Borg CR-10 [M = 5.3, DT = 2.0]). No se observaron diferencias con significación estadística entre los grupos de estudio. Al final de la intervención, estos participantes mejoraron su adaptación al esfuerzo y alcanzaron el esfuerzo máximo tan bien como en el seguimiento. Se observó un efecto temporal positivo moderado para VO2pico sin efectos grupales del estudio (Tabla 3b). Siete participantes (63.6 %) mejoraron su VO2pico en al menos 3.5 ml/kg/min al final de la intervención y este siguió siendo elevado en seis de ellos cuando se hizo la evaluación de seguimiento.

Tabla 3b
Datos de las pruebas de capacidad cardiorrespiratoria al inicio (T0), después de la intervención (T1) y en el seguimiento a las 24 semans (T2) para el supuesto B (n = 11).
Supuesto C: Seis participantes tuvieron que abandonar la prueba de ejercicio cardiorrespiratorio al inicio y al final de la intervención, pero pudieron alcanzar los criterios máximos en el seguimiento (valores de TIRpico [M = 1.2, DT = 0.09], cronotropía [M = 94.6 %, DT = 12.1], Borg CR-10 [M = 7.3, DT = 1.7].
Aunque al final de la intervención (T1) estos participantes tuvieron que abandonar la prueba cardiorrespiratoria, VO2pico mostró un gran aumento significativo. En el seguimiento, VO2pico mejoró aún más, y los 6 participantes aumentaron VO2pico en más de 3.5 ml/kg/min (Tabla 3c).

Tabla 3c
Datos de la prueba de capacidad cardiorrespiratoria al inicio (T0), después de la intervención (T1) y en el seguimiento a las 24 semanas (T2) para el supuesto C (n = 6).
Datos independientes del esfuerzo
Se observaron mejorías pequeñas pero significativas en CTPCR, VO2PCR y PECO al final de la intervención sin efecto grupal. Estos aumentos no persistían en el seguimiento. Sin embargo, considerando solamente los supuestos B y C; CTPCR, VO2PCR y PECO mostraron aumentos grandes y persistentes. No se apreciaron diferencias entre los grupos de estudio. No se observó ningún efecto temporal en la pendiente de VE-VCO2.
Discusión y conclusión
El presente estudio evalúa la eficacia de una intervención de 16 semanas de un programa de ejercicio de entrenamiento interválico aeróbico (EIA) semisupervisado junto con asesoramiento sobre hábitos adecuados sobre la capacidad cardiorrespiratoria (CCR) en cuanto a VO2pico, VO2PCR, pendiente de VE-VCO2 y PECO, en adultos sedentarios con factores de riesgo cardiometabólico. La intervención se llevó a cabo en un entorno extraacadémico y se comparó con el entrenamiento continuo de intensidad entre baja y moderada más asesoramiento sobre hábitos adecuados (ECT) y solamente con asesoramiento sobre hábitos adecuados (AHA).
El EIA fue bien aceptado por los participantes, con niveles bastante altos de cumplimiento de las sesiones de ejercicio. Todos los grupos del estudio mostraron ligeros descensos comparables en PGSM y cambios positivos en los hábitos que persistieron a medio plazo.
Asimismo, todos los programas de intervención indujeron cambios significativos en las variables de CCR. Aunque los efectos de la intervención de EIA sobre CCR y la adaptación fisiológica al esfuerzo no difirieron sustancialmente respecto al ECT o el AHA, el número de participantes que aumentaron su VO2pico fue ligeramente superior. Los cambios en VO2pico diferían en función de si la adaptación fisiológica a las pruebas de ejercicio máximo graduado era satisfactoria o no al inicio del estudio. La intervención fue más eficaz en las personas con una peor adaptación fisiológica al ejercicio graduado. Todos los programas de intervención causaron aumentos significativos comparables no persistentes en el VO2UV, ningún cambio en la pendiente de VE-VCO2 y mejorías persistentes en la PECO.
Varios estudios recientes han demostrado que el EIAI es eficaz para producir mejorías entre leves y moderadas en VO2pico/VO2máx. tras periodos de entre 4 semanas (12 sesiones) y 16 semanas (48 sesiones) (Blackwell et al., 2017). Dos metaanálisis anteriores informaron de mayores efectos del entrenamiento de alta intensidad en comparación con el entrenamiento moderado-continuo (Milanović et al., 2015; Pattyn et al., 2014).
Estos estudios fueron mayoritariamente supervisados y solo informaron de los datos de las personas que alcanzaron el ejercicio limitado por los síntomas en la prueba de CCR. Informaron de aumentos de VO2pico que oscilaban entre el 9 y el 27 % (Blackwell et al., 2017; Guio de Prada et al., 2019b). Estas cifras son mayores que las nuestras. Sin embargo, el presente estudio difiere de los demás por su carácter semisupervisado y por la frecuencia semanal descendente de las sesiones supervisadas. Asimismo, dado que la mayoría de estudios solo incluyen a personas que completaron al menos el 85 % de las sesiones de entrenamiento, no puede descartarse que esas cifras tan altas se debieran a la exclusión del análisis de las personas que no lograron resultados positivos. Nuestros datos concuerdan con Blackwell et al. (2017), que observaron una menor mejoría del VO2pico en el grupo que entrenó en casa (≈ 10 %) que en el grupo que recibió entrenamiento de ejercicio supervisado (≈ 20 %).
Si bien la intensidad del ejercicio parece ser un factor decisivo para mejorar la CCR, el nivel inicial de CCR determina la intensidad individual del ejercicio necesaria para generar aumentos con significación clínica. Las personas con baja forma física (CCR < 10 equivalente metabólico [EM]) necesitarán una intensidad de entrenamiento del 50 % de reserva de frecuencia cardiaca (RFC) o de reserva de VO2 (VO2R), mientras que una persona con alta forma física (CCR > 14 EM) necesitará una intensidad mayor (> 85 % de RFC o VO2R) (Ross et al., 2016). Esto podría explicar por qué los participantes que al inicio alcanzaron los criterios de esfuerzo máximo no mejoraron su VO2pico. En estos participantes, es posible que la carga total de entrenamiento haya sido demasiado baja para generar grandes cambios en la VO2pico en los grupos de estudio. No obstante, el hecho de que el número de participantes en EIA que mejoraron su VO2pico fuera mayor que en ECT y AHA parece apoyar la hipótesis de que incluso un EIA semisupervisado puede ser más eficaz que ECT y AHA.
Por el contrario, en el caso de los participantes que presentaban una mala adaptación al esfuerzo graduado al inicio del estudio, es posible que la carga de entrenamiento o incluso el cambio en el estilo de vida fueran suficientes para generar una mejor respuesta al esfuerzo. Así, en ese caso, se registraron grandes mejorías en el VO2pico en todos los grupos del estudio. Esto concuerda con los hallazgos del metaanálisis de Milanović (Milanović et al., 2015) que revelaron una probable mejoría moderadamente mayor en el VO2máx. para los participantes con una CCR inicial más baja (tanto para el entrenamiento de alta intensidad como para el de resistencia).
Una baja forma física cardiorrespiratoria (VO2pico) es un fuerte factor de predicción independiente de mortalidad prematura (Lee et al., 2010) que se ha relacionado con un mayor riesgo de síndrome metabólico (Lee, 2020), por lo que incluso pequeñas mejorías de la CCR pueden tener efectos positivos sobre la salud.
La mayoría de las actividades de la vida diaria no requiere un esfuerzo máximo; por ello, se ha propuesto que los indicadores de la capacidad de ejercicio submáxima podrían ser interesantes desde el punto de vista de la salud (Balady et al., 2010). Los umbrales ventilatorios (UV y PCR) son índices de la capacidad de ejercicio submáxima empleados frecuentemente. En el campo del ejercicio y la salud, varios estudios informan de aumentos de la carga de trabajo y del VO2 alcanzado en el primer umbral ventilatorio (UV) en personas sedentarias (Blackwell et al., 2017) o en pacientes con síndrome metabólico (Guio de Prada et al., 2019a) o con ICC (Kemps et al., 2010). Hasta donde sabemos, pocos estudios han analizado los efectos del entrenamiento sobre el segundo umbral ventilatorio (PCR). Guio de Prada et al. (2019b) informaron de un aumento del UV y del PCR tras EIAI en 76 personas sedentarias con obesidad. Nuestros resultados confirman que el PCR también es sensible a los efectos del entrenamiento semisupervisado, pero los cambios no son persistentes.
La pendiente de VE-VCO2 refleja la ventilación para una determinada producción de VCO2 (Akkerman et al., 2010) y se ha considerado un indicador de la CCR y un factor de predicción de la mortalidad en pacientes con insuficiencia cardiaca crónica (ICC). En el presente estudio, ninguno de los tres programas de intervención influyó en la pendiente de VE-VCO2. Nuestros datos concuerdan con otros estudios que no han observado cambios en la pendiente de VE-VCO2 tras el entrenamiento con ejercicio en pacientes con enfermedades cardiovasculares (Kemps et al., 2010; Nilsson et al., 2019; Pattyn et al., 2014), pero contrastan con otros que informaron de disminuciones de la pendiente de VE-VCO2 en personas con valores elevados (>35) al inicio (Van Laethem et al., 2007). Así pues, los posibles cambios generados por el entrenamiento podrían ser más limitados en los participantes con valores de pendiente dentro del intervalo normal de 20-30. Aun así, Anaya (Anaya et al., 2009) ha informado de una tendencia significativa dependiente de la dosis para los cambios de la pendiente de VE-VCO2 en mujeres posmenopáusicas.
En el presente estudio, la ausencia de cambios en la pendiente de VE-VCO2 podría atribuirse a una carga de entrenamiento demasiado baja como para generar cambios en la pendiente de VE-VCO2 o, como alternativa, podría deberse a que la pendiente de VE-VCO2 no es lo suficientemente sensible a los efectos del entrenamiento con ejercicio en personas sedentarias con valores de pendiente inferiores a 30.
La PECO se considera una medida integrada que refleja la coordinación de los sistemas pulmonar y cardiovascular y la extracción de O2 durante el ejercicio (Balady et al., 2010). Nuestros datos muestran que todos los programas de intervención generaron mejorías significativas comparables en la PECO. Parece que la PECO puede ser más sensible al cambio que la pendiente de VE-VCO2. Los datos son coherentes con otros estudios que han informado de mejorías similares en la PECO tras intervenciones de entrenamiento con ejercicio en pacientes con enfermedades cardiometabólicas (Kemps et al., 2010; Nilsson et al., 2019). Sin embargo, en otro estudio (Mourot et al., 2004), en el que las participantes eran mujeres jóvenes sanas y físicamente activas, 18 sesiones de entrenamiento de resistencia intermitente no tuvieron efectos sobre la PECO ni sobre la pendiente de VE-VCO2, a pesar de aumentos significativos del VO2pico y del VO2UV.
La naturaleza semisupervisada del entrenamiento podría considerarse una limitación. En este estudio, los participantes estuvieron estrechamente supervisados por un profesional de la actividad física al principio del programa, pero con el tiempo debían ser más autónomos. Esto puede explicar la falta de mayores efectos de los programas de entrenamiento con ejercicio sobre la capacidad cardiorrespiratoria (VO2pico, VO2PCR, pendiente de VE-VCO2 y PECO) en comparación con el grupo de AHA u otros estudios. Somos conscientes de que no hicimos un seguimiento adecuado de los participantes durante las sesiones individuales sin supervisión. El incumplimiento de la carga de entrenamiento prevista podría dar lugar a estímulos de entrenamiento inferiores y, por tanto, a adaptaciones inferiores. Para el trabajo futuro de investigación, recomendamos aumentar el número de sesiones de formación supervisadas y reforzar el seguimiento de las sesiones sin supervisión con estrategias tales como plataformas de comunicación electrónicas.
Uno de los principales puntos fuertes de este estudio fue que la intervención de 16 semanas combinó el programa de entrenamiento de ejercicio semisupervisado con el asesoramiento sobre hábitos adecuados para promover un cambio de comportamiento. Este estudio es único ya que, a diferencia de otros estudios de EIA, no solo tiene en cuenta el ejercicio físico, sino que también lo vincula a estrategias que promueven el cambio de comportamiento y la capacitación, y evalúa la persistencia a medio plazo de los efectos. La mayoría de las intervenciones de EIA se han realizado en un entorno experimental muy controlado durante un periodo de tiempo limitado y solo informan de sus efectos inmediatos. En el presente estudio, diversos cambios beneficiosos (CCR y hábitos), en particular en las personas con menor nivel de forma física (VO2pico, PECO), persistieron en el seguimiento a las 24 semanas.
En conclusión, el estudio demuestra que una intervención de 16 semanas de EIA semisupervisado junto con asesoramiento sobre hábitos adecuados podría ser (1) una estrategia susceptible de traducirse en el programa extracadémico de ejercicio en el mundo real dirigido a personas sedentarias con factores de riesgo cardiometabólico; y tuvo (2) la misma eficacia que los programas de ECT o AHA en el aumento del VO2pico en personas con baja forma física, aunque el número de personas lograron resultados positivos fue mayor en el grupo de estudio de EIA que en los de ECT o AHA; y (3) tan eficaz como ECT o AHA en la mejoría de las variables independientes del esfuerzo como el VO2PCR, y la PECO. Sin embargo, (4) ninguno de los tres programas de intervención afectó a la pendiente de VE-VCO2.
Glosario
AFMV: actividad física entre moderada e intensa
CCR: capacidad cardiorrespiratoria
ECT: entrenamiento continuo tradicional
EIA: entrenamiento interválico aeróbico
EIAI: entrenamiento interválico de alta intensidad
EM: equivalente metabólico
FC: frecuencia cardiaca
IAS: índice de alimentación saludable
MV: magnitud vectorial
PAD: presión arterial diastólica
PAM: presión arterial media
PAS: presión arterial sistólica
PCR: punto de compensación respiratoria
PECO: pendiente de la eficiencia del consumo de oxígeno
PECP: prueba de esfuerzo cardiopulmonar
Pendiente de VE-VCO2: índice de eficiencia ventilatoria
PET CO2: presión parcial de CO2
PGSM: puntuación de gravedad del síndrome metabólico
RMM: recuentos medios por minuto
S: sedentarismo
SM: síndrome metabólico
TIR: tasa de intercambio respiratorio
VCO2: producción de dióxido de carbono
VE: ventilación
VE-VCO2: equivalente ventilatorio de CO2
VE-VO2: equivalente ventilatorio del consumo de oxígeno
VO2: consumo de oxígeno
VO2PCR: consumo de oxígeno en el punto de compensación respiratoria
VO2pico: consumo de oxígeno pico
Referencias
[1] Akkerman, M., Van Brussel, M., Hulzebos, E., Vanhees, L., Helders, P. J. M., & Takken, T. (2010). The Oxygen Uptake Efficiency Slope. Journal of Cardiopulmonary Rehabilitation and Prevention, 30(6), 357–373. https://doi.org/10.1097/HCR.0b013e3181ebf316
[2] Anaya, S. A., Church, T. S., Blair, S. N., Myers, J. N., & Earnest, C. P. (2009). Exercise dose-response of the V̇ E/V̇CO 2 slope in postmenopausal women in the DREW study. Medicine and Science in Sports and Exercise, 41(5), 971–976. https://doi.org/10.1249/MSS.0b013e3181930009
[3] Arena, R., Myers, J., Aslam, S. S., Varughese, E. B., & Peberdy, M. A. (2003). Technical considerations related to the minute ventilation/carbon dioxide output slope in patients with heart failure. Chest, 124(2), 720–727. https://doi.org/10.1378/chest.124.2.720
[4] Baba, R., Nagashima, M., Goto, M., Nagano, Y., Yokota, M., Tauchi, N., & Nishibata, K. (1996). Oxygen uptake efficiency slope: A new index of cardiorespiratory functional reserve derived from the relation between oxygen uptake and minute ventilation during incremental exercise. Journal of the American College of Cardiology, 28(6), 1567–1572. https://doi.org/10.1016/S0735-1097(96)00412-3
[5] Balady, G. J., Arena, R., Sietsema, K., Myers, J., Coke, L., Fletcher, G. F., Forman, D., Franklin, B., Guazzi, M., Gulati, M., Keteyian, S. J., Lavie, C. J., Macko, R., & Mancini, D. (2010). Clinician’s Guide to Cardiopulmonary Exercise Testing in Adults A Scientific Statement From the American Heart Association. 191–225. https://doi.org/10.1161/CIR.0b013e3181e52e69
[6] Basiotis, P., Carlson, A., Gerrior, S., Juan, W., & Lino, M. (2002). The Healthy Eating Index 1999-2000. Washington, DC: US Department of Agriculture, Center for Nutrition Policy and Promotion. https://www.usda.gov
[7] Beaver, W. L., Wasserman, K., & Whipp, B. J. (1986). A new method for detecting anaerobic threshold by gas exchange. Journal of Applied Physiology, 60(6), 2020–2027. https://doi.org/10.1152/jappl.1986.60.6.2020
[8] Blackwell, J., Atherton, P. J., Smith, K., Doleman, B., Williams, J. P., Lund, J. N., & Phillips, B. E. (2017). The efficacy of unsupervised home-based exercise regimens in comparison to supervised laboratory-based exercise training upon cardio-respiratory health facets. Physiological Reports, 5(17). https://doi.org/10.14814/phy2.13390
[9] Borg, E., & Kaijser, L. (2006). A comparison between three rating scales for perceived exertion and two different work tests. Scandinavian Journal of Medicine and Science in Sports, 16(1), 57–69. https://doi.org/10.1111/j.1600-0838.2005.00448.x
[10] Cook, R. J., Dickens, B. M., & Fathalla, M. F. (2003). World Medical Association Declaration of Helsinki: Ethical Principles for Medical Research Involving Human Subjects. In Reproductive Health and Human Rights (Vol. 81, Issue 3, pp. 428–432). Oxford: Oxford University Press. https://doi.org/10.1093/acprof:oso/9780199241323.003.0025
[11] Ensenyat, A., Espigares-Tribo, G., Machado-Da-Silva, L., Sinfreu-Bergués, X., & Blanco, A. (2020). Semisupervised physical exercise and lifestyle counseling in cardiometabolic risk management in sedentary adults: Controlled randomized trial (BELLUGAT). Journal of Physical Activity and Health, 17(7), 744–755. https://doi.org/10.1123/jpah.2019-0409
[12] Ensenyat, A., Espigares-Tribo, G., Machado, L., Verdejo, F. J., Rodriguez-Arregui, R., Serrano, J., Miret, M., Galindo, G., Blanco, A., Marsal, J.-R., Sarriegui, S., Sinfreu-Bergues, X., & Serra-Paya, N. (2017). Metabolic risk management, physical exercise and lifestyle counselling in low-active adults: controlled randomized trial (BELLUGAT). BMC Public Health, 17(1), 257. https://doi.org/10.1186/s12889-017-4144-8
[13] Faul, F., Erdfelder, E., Lang, A.-G., & Buchner, A. (2007). G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods, 39(2), 175–191. https://doi.org/10.3758/BF03193146
[14] Gami, A. S., Witt, B. J., Howard, D. E., Erwin, P. J., Gami, L. A., Somers, V. K., & Montori, V. M. (2007). Metabolic Syndrome and Risk of Incident Cardiovascular Events and Death. A Systematic Review and Meta-Analysis of Longitudinal Studies. Journal of the American College of Cardiology, 49(4), 403–414. https://doi.org/10.1016/j.jacc.2006.09.032
[15] Guio de Prada, V., Ortega, J. F., Morales-Palomo, F., Ramirez-Jimenez, M., Moreno-Cabañas, A., & Mora-Rodriguez, R. (2019a). Women with metabolic syndrome show similar health benefits from high-intensity interval training than men. PloS One, 14(12), e0225893. https://doi.org/10.1371/journal.pone.0225893
[16] Guio de Prada, V., Ortega, J. F., Ramirez-Jimenez, M., Morales-Palomo, F., Pallares, J. G., & Mora-Rodriguez, R. (2019b). Training intensity relative to ventilatory thresholds determines cardiorespiratory fitness improvements in sedentary adults with obesity. European Journal of Sport Science, 19(4), 549-556. https://doi.org/10.1080/17461391.2018.1540659
[17] Kemps, H. M. C., De Vries, W. R., Schmikli, S. L., Zonderland, M. L., Hoogeveen, A. R., Thijssen, E. J. M., & Schep, G. (2010). Assessment of the effects of physical training in patients with chronic heart failure: The utility of effort-independent exercise variables. European Journal of Applied Physiology, 108(3), 469–476. https://doi.org/10.1007/s00421-009-1230-3
[18] Knaeps, S., Bourgois, J. G., Charlier, R., Mertens, E., Lefevre, J., & Wijndaele, K. (2018). Ten-year change in sedentary behaviour, moderate-to-vigorous physical activity, cardiorespiratory fitness and cardiometabolic risk: independent associations and mediation analysis. British Journal of Sports Medicine, 52(16), 1063–1068. https://doi.org/10.1136/bjsports-2016-096083
[19] Lee, D., Artero, E. G., Xuemei Sui, & Blair, S. N. (2010). Review: Mortality trends in the general population: the importance of cardiorespiratory fitness. Journal of Psychopharmacology, 24(4_suppl), 27–35. https://doi.org/10.1177/1359786810382057
[20] Lee, J. (2020). Influences of Cardiovascular Fitness and Body Fatness on the Risk of Metabolic Syndrome: A Systematic Review and Meta-Analysis. American Journal of Health Promotion, 34(7), 796–805. https://doi.org/10.1177/0890117120925347
[21] Milanović, Z., Sporiš, G., & Weston, M. (2015). Effectiveness of High-Intensity Interval Training (HIT) and Continuous Endurance Training for VO2max Improvements: A Systematic Review and Meta-Analysis of Controlled Trials. Sports Medicine, 45(10), 1469–1481. https://doi.org/10.1007/s40279-015-0365-0
[22] Mourot, L., Perrey, S., Tordi, N., & Rouillon, J. D. (2004). Evaluation of Fitness Level by the Oxygen Uptake Efficiency Slope After a Short-Term Intermittent Endurance Training. International Journal of Sports Medicine, 25(2), 85–91. https://doi.org/10.1055/s-2004-819943
[23] Myers, J., McAuley, P., Lavie, C. J., Despres, J.-P., Arena, R., & Kokkinos, P. (2015). Physical Activity and Cardiorespiratory Fitness as Major Markers of Cardiovascular Risk: Their Independent and Interwoven Importance to Health Status. Progress in Cardiovascular Diseases, 57(4), 306–314. https://doi.org/10.1016/j.pcad.2014.09.011
[24] Nilsson, H., Nylander, E., Borg, S., Tamás, É., & Hedman, K. (2019). Cardiopulmonary exercise testing for evaluation of a randomized exercise training intervention following aortic valve replacement. Clinical Physiology and Functional Imaging, 39(1), 103–110. https://doi.org/10.1111/cpf.12545
[25] Pattyn, N., Coeckelberghs, E., Buys, R., Cornelissen, V. A., & Vanhees, L. (2014). Aerobic Interval Training vs. Moderate Continuous Training in Coronary Artery Disease Patients: A Systematic Review and Meta-Analysis. Sports Medicine, 44(5), 687–700. https://doi.org/10.1007/s40279-014-0158-x
[26] Pattyn, N., Cornelissen, V. A., Eshghi, S. R. T., & Vanhees, L. (2013). The effect of exercise on the cardiovascular risk factors constituting the metabolic syndrome: A meta-analysis of controlled trials. Sports Medicine, 43(2), 121–133. https://doi.org/10.1007/s40279-012-0003-z
[27] Pedersen, B. K., & Saltin, B. (2015). Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports, 25, 1–72. https://doi.org/10.1111/sms.12581
[28] Ross, R., Blair, S. N., Arena, R., Church, T. S., Després, J.-P., Franklin, B. A., Haskell, W. L., Kaminsky, L. A., Levine, B. D., Lavie, C. J., Myers, J., Niebauer, J., Sallis, R., Sawada, S. S., Sui, X., & Wisløff, U. (2016). Importance of Assessing Cardiorespiratory Fitness in Clinical Practice: A Case for Fitness as a Clinical Vital Sign: A Scientific Statement From the American Heart Association. Circulation, 134(24). https://doi.org/10.1161/CIR.0000000000000461
[29] Schulz, Altman, D. G., & Moher, D. (2011). CONSORT 2010 statement: Updated guidelines for reporting parallel group randomised trials. International Journal of Surgery, 9(8), 672–677. https://doi.org/10.1016/j.ijsu.2011.09.004
[30] Tjønna, A. E., Lee, S. J., Rognmo, Ø., Stølen, T. O., Bye, A., Haram, P. M., Loennechen, J. P., Al-Share, Q. Y., Skogvoll, E., Slørdahl, S. A., Kemi, O. J., Najjar, S. M., & Wisløff, U. (2008). Aerobic Interval Training Versus Continuous Moderate Exercise as a Treatment for the Metabolic Syndrome. Circulation, 118(4), 346–354. https://doi.org/10.1161/CIRCULATIONAHA.108.772822
[31] Tjønna, A. E., Ramos, J. S., Pressler, A., Halle, M., Jungbluth, K., Ermacora, E., Salvesen, Ø., Rodrigues, J., Bueno, C. R., Munk, P. S., Coombes, J., & Wisløff, U. (2018). EX-MET study: exercise in prevention on of metabolic syndrome – a randomized multicenter trial: rational and design. BMC Public Health, 18(1), 437. https://doi.org/10.1186/s12889-018-5343-7
[32] Troiano, R. P., Berrigan, D., Dodd, K. W., Mâsse, L. C., Tilert, T., & Mcdowell, M. (2008). Physical Activity in the United States Measured by Accelerometer. Medicine & Science in Sports & Exercise, 40(1), 181–188. https://doi.org/10.1249/mss.0b013e31815a51b3
[33] Van Laethem, C., Van De Veire, N., De Backer, G., Bihija, S., Seghers, T., Cambier, D., Vanderheyden, M., & De Sutter, J. (2007). Response of the oxygen uptake efficiency slope to exercise training in patients with chronic heart failure. European Journal of Heart Failure, 9(6–7), 625–629. https://doi.org/10.1016/j.ejheart.2007.01.007
[34] WHO. (2018). Healthy-lifestyle counselling. In HEARTS Technical package for cardiovascular disease management in primary health care. https://apps.who.int/iris/bitstream/handle/10665/260422/WHO-NMH-NVI-18.1-eng.pdf?sequence=1
[35] Wiley, J. F., & Carrington, M. J. (2016). A metabolic syndrome severity score: A tool to quantify cardio-metabolic risk factors. Preventive Medicine, 88, 189–195. https://doi.org/10.1016/J.YPMED.2016.04.006
[36] Wisløff, U., Støylen, A., Loennechen, J. P., Bruvold, M., Rognmo, Ø., Haram, P. M., Tjønna, A. E., Helgerud, J., Slørdahl, S. A., Lee, S. J., Videm, V., Bye, A., Smith, G. L., Najjar, S. M., Ellingsen, Ø., & Skjærpe, T. (2007). Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: A randomized study. Circulation, 115(24), 3086–3094. https://doi.org/10.1161/CIRCULATIONAHA.106.675041
[37] World Health Organization. (2011). Waist Circumference and Waist–Hip Ratio: Report of a WHO Expert Consultation: Ginebra, 8-11, 2011. 1, 8–11. www.who.int
ISSN: 2014-0983
Recibido: 8 de septiembre de 2022
Aceptado: 22 de febrero de 2023
Publicado: 1 de octubre de 2023
Editado por: © Generalitat de Catalunya Departament de la Presidència Institut Nacional d’Educació Física de Catalunya (INEFC)
© Copyright Generalitat de Catalunya (INEFC). Este artículo está disponible en la url https://www.revista-apunts.com/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES



