Intervención nutricional durante la lesión muscular considerando su fisiopatología: artículo de revisión
*Correspondencia: Luis Vergara-Gutiérrez luisvergara@medicinadeldeporte.cl
Citación
Vergara-Gutiérrez, L., Lizárraga-Dallo, A., & Pruna-Grive, R. (2020). Nutritional Intervention during Muscle Injury Considering its Pathophysiology: Review Article. Apunts. Educación Física y Deportes, 142, 8-20. https://doi.org/10.5672/apunts.2014-0983.es.(2020/4).142.02
Resumen
La lesión genera costos físicos, emocionales y económicos, por lo que se han buscado estrategias para acortar al máximo el período de recuperación. Una herramienta infrautilizada es la nutricional. Se presenta una revisión de la literatura científica mediante una búsqueda en 4 bases de datos (Pubmed/MEDLINE, Epistemonikos, Embase y Sportdiscus) sobre la fisiopatología de la lesión muscular y su modulación nutricional. Se describen cambios locales mediados por células y mediadores inflamatorios, y cambios secundarios en la composición corporal. Las intervenciones nutricionales publicadas comprenden el aumento de las proteínas de la dieta y ajuste de carbohidratos acorde a su menor gasto energético. No existen estudios que hayan evaluado directamente el uso de suplementos durante la lesión, pero sí evidencia indirecta, la mayoría favorable, en sarcopenia y recuperación muscular. La intervención nutricional durante la lesión es fundamental para disminuir las consecuencias negativas de la inactividad, la cual debe ser indicada de manera individualizada.
Introducción
La aparición de una lesión es una situación que, si bien se trata de evitar, es inherente a la vida del deportista. No solo involucra costos físicos, sino también emocionales y económicos, tanto para el jugador como para la institución, como es el caso de los deportes de equipo (Wall et al., 2014). Se sabe que la mitad de las lesiones deportivas pueden considerarse graves, con un promedio de inactividad mayor a 3 semanas sin entrenar ni competir (Tipton, 2015). Toda lesión prolongada trae consigo períodos de reposo, generando pérdida de masa, fuerza y función muscular (Pierre et al., 2016), por lo que toda intervención para disminuir el período de inmovilidad será importante. Por otra parte, el retorno a la competición puede retrasarse todavía más por la atrofia muscular y el aumento de grasa abdominal, lo que puede demorar varias semanas en resolverse. Esta acumulación de tejido adiposo “no deseado” es agravado por la reducción de la tasa metabólica local del tejido dañado y por una disminución en la sensibilidad del músculo a la insulina (Abadi et al., 2009; Pierre et al., 2016).
En la actualidad existen diversos tratamientos para favorecer y acortar el período de recuperación, tales como la crioterapia, masoterapia, electroestimulación muscular y acupuntura entre otros (Dupuy et al., 2018). Por otra parte, se ha intentado investigar nuevos tratamientos para acortar la recuperación, como es el caso del plasma rico en plaquetas, anticuerpos monoclonales que inactivan citoquinas inflamatorias o la inyección local de factores de crecimiento entre otras técnicas invasivas. Muchas de estas tienen un alto coste, y presentan eventuales complicaciones y efectos adversos (Bachl et al., 2009; Mehrabani et al., 2019; Stöllberger y Finsterer, 2019).
Un aspecto poco estudiado, y por momentos subestimado, es el factor nutricional. La alimentación adecuada durante el período de la lesión no solo puede ayudar a prevenir la acumulación de grasa abdominal, sino que también podría optimizar el proceso de regeneración de los tejidos y disminuir la atrofia muscular. Desde hace varios años que se sabe que la alimentación puede activar o inactivar la expresión de nuestro genoma. Un claro ejemplo es el de la leucina, un aminoácido esencial que se obtiene de los alimentos que es capaz de activar la vía mTOR, activando la síntesis proteica, por lo que es utilizado por muchos deportistas para ganar masa muscular (Duan et al., 2015; Li et al., 2011). Si fuera posible planificar junto al deportista lesionado una pauta alimentaria con un adecuado aporte de proteínas, alimentos con propiedades antiinflamatorias o que fuesen capaces de modular la respuesta inmune, se podría optimizar el período de recuperación, logrando regeneración tisular de mejor calidad en el menor tiempo posible.
Desde hace siglos, muchas culturas han utilizado alimentos con posibles efectos antiinflamatorios. Sin embargo, en su gran mayoría carecen de evidencia científica para poder recomendarlo a los deportistas. No solo se desconocen su utilidad, sino también su mecanismo de acción, la dosis adecuada o los posibles efectos adversos. Es por ello que es muy importante disponer de evidencia científica de la mayor calidad posible para poder indicarlos con la seguridad de su eficacia evitando así resultados desfavorables.
En los últimos años, se han llevado a cabo estudios que comprueban los efectos inmunomoduladores y antiinflamatorios de ciertos alimentos, la mayoría de ellos realizados en pacientes con sarcopenia o en recuperación muscular después de una sesión de ejercicio excéntrico (Beaudart et al., 2017; 2018; Chevalley et al., 2010; Colonetti et al., 2016; Cooke et al., 2010; Sousa et al., 2013). Su aplicación en la medicina del deporte, específicamente durante una lesión deportiva, es un área poco desarrollada, pero con un enorme potencial como línea de investigación futura, considerando la disminución de costos personales y económicos que trae consigo esta intervención. Por esta razón, el objetivo de la presente revisión es detallar la fisiopatología de la lesión muscular en cada una de sus etapas, para luego exponer los aspectos más importantes a considerar en el momento de realizar una intervención nutricional basada en la evidencia científica disponible.
Metodología
Estudio descriptivo transversal de artículos publicados mediante una revisión narrativa. Se realizó una búsqueda entre febrero y julio de 2019 en 4 bases de datos (Pubmed/MEDLINE, Epistemonikos, Embase y Sportdiscus) de artículos científicos referentes a la fisiopatología de la lesión muscular y su intervención nutricional durante la fase de recuperación. Se incluyeron publicaciones desde el inicio de la indexación privilegiando la búsqueda de revisiones sistemáticas y de metanálisis de los últimos 3 años acorde a la clasificación de la calidad de la evidencia vigente en la actualidad. Se excluyeron publicaciones que no estuvieran en castellano o inglés, como también aquellas que no estuvieran disponibles en bases de datos electrónicas. Inicialmente se realizó una búsqueda de palabras clave mediante la herramienta Mesh como injury, athletic injuries, sports injury, nutrition, muscle regeneration, creatine, protein, whey protein, beta-hydroxy-beta-methylbutyrate, HMB, curcumin, vitamin D, Fatty Acids, Omega-3, Montmorency tart cherry y tart cherry. Posteriormente se realizó una nueva búsqueda utilizando operadores booleanos como : “nutrition” OR “sports nutrition” AND “inj*”, “Athletic Inj*” OR “sports inj*” AND “Sports Nutritional Sciences”, “Athletic Inj*” AND “nutrition”, “muscle Inj*” AND “nutrition”, “protein” AND “athletic Inj*” OR “sports inj*”, “creatine” AND “athletic Inj*” OR “sports inj*”, “curcumin” AND “athletic Inj*” OR “sports inj*”, “Fatty Acids, Omega-3” AND “athletic Inj*” OR “sports inj*”, “vitamin D” AND “athletic Inj*” OR “sports inj*”, “tart cherry” OR “montmorency tart cherry” AND “athletic Inj*” OR “sports inj*”. Se encontraron 21.498 artículos, de los cuales se eliminaron estudios duplicados y aquellos que no correspondían a los objetivos del estudio, resultando finalmente 202 publicaciones que fueron finalmente consideradas en la revisión. En los artículos de revisión hallados se acudió a los estudios primarios considerados por la autoría. En caso de no encontrar estudios cuyo objetivo directo fuese la lesión deportiva, se buscó la mejor evidencia indirecta disponible, como la intervención nutricional en la recuperación de la inflamación muscular, sarcopenia en adultos mayores o en pacientes hospitalizados después de cirugías. Un resumen de la estrategia de búsqueda se muestra en la figura 1.
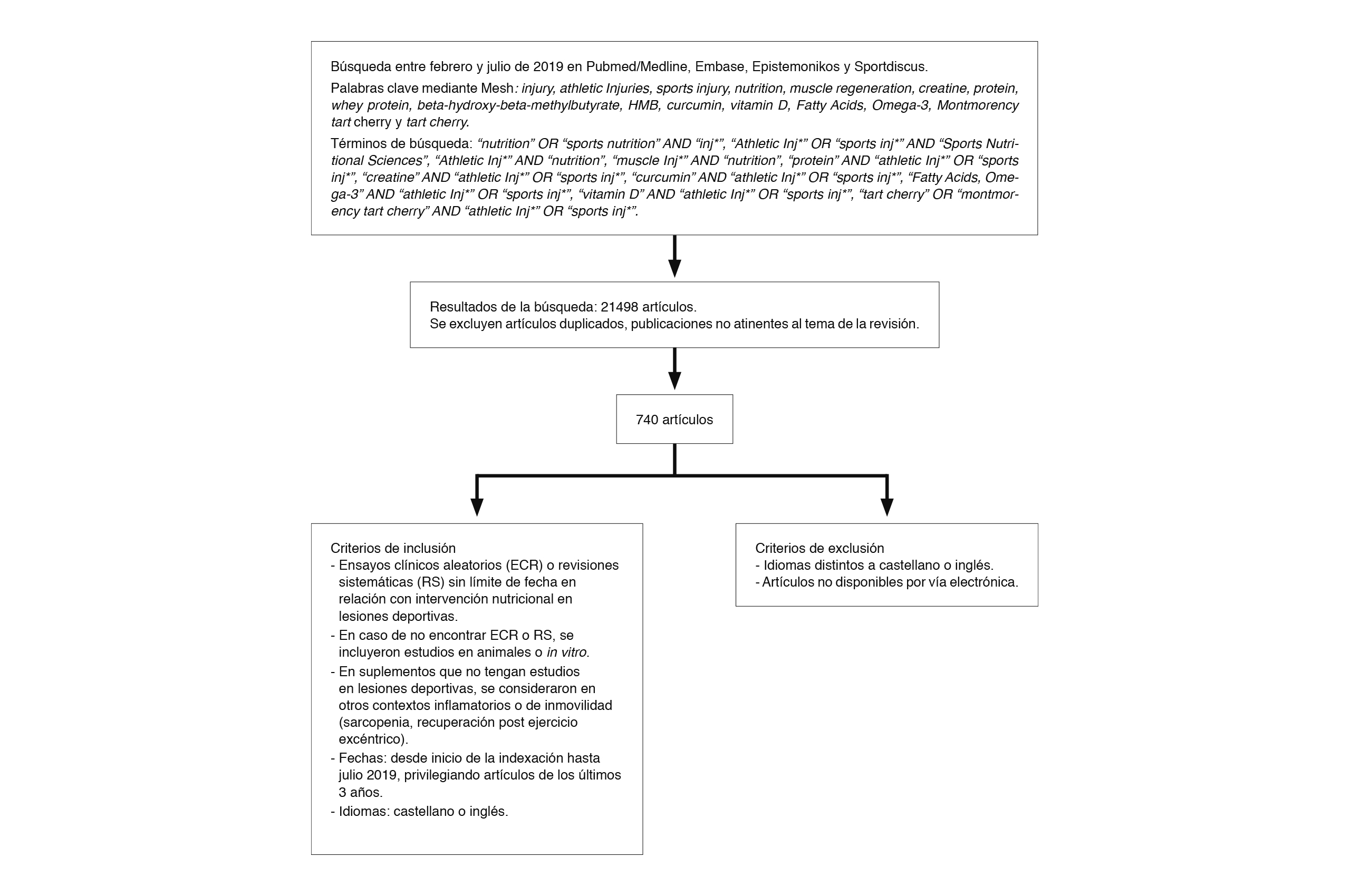
Resultados
No se encontraron revisiones sistemáticas ni ensayos clínicos aleatorios referentes a la intervención nutricional durante la lesión deportiva, lo que imposibilita la realización de revisiones sistemáticas referentes al tema. Solamente se encontraron 5 revisiones narrativas del tema (Close et al., 2019; Medina et al., 2014; Tipton, 2010; 2015; Wall et al., 2014), describiendo de manera general posibles intervenciones nutricionales durante el período de recuperación. Por otra parte, se encontraron 152 artículos relacionados con suplementos que podían ser útiles considerando sus posibles mecanismos de acción.
Cambios locales en el sitio de la lesión muscular
Fisiopatología de la lesión muscular
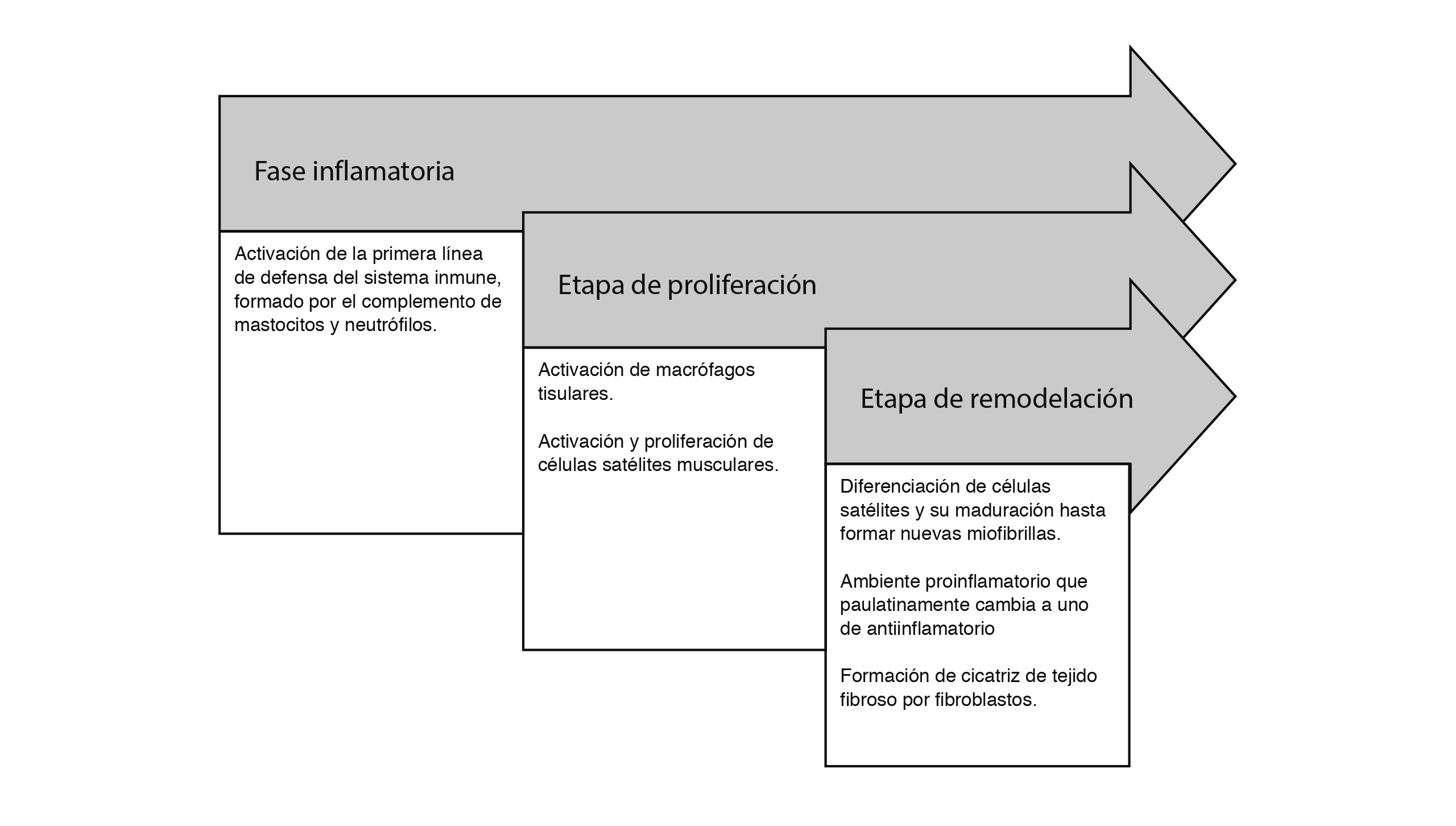
Si bien existen diversas clasificaciones, una de las más utilizadas divide los cambios de la lesión muscular en tres fases, que se sobreponen, siendo difícil poder delimitar el inicio y fin de ellas ya que ocurren de manera simultánea. La etapa de inflamación se inicia desde el momento de la lesión hasta el séptimo día, participando neutrófilos, macrófagos y linfocitos. La fase de regeneración se considera aproximadamente desde el segundo hasta el séptimo día, ocurriendo la activación y proliferación de las células satélite (stem cells musculares) que migran y se fusionan con las fibras musculares dañadas. Finalmente, existe la fase de remodelación que involucra desde el quinto día hasta la cuarta semana, cuando se forman y se regeneran fibras musculares y la matriz extracelular (Cheng et al., 2008). Estas fases aparecen sintetizadas en la figura 2.
1) Etapa de inflamación
Inmediatamente después de ocurrida la lesión, se inicia una respuesta inflamatoria, que tiene una duración variable, desde algunas horas hasta varios días dependiendo del tipo y severidad del daño (Tipton, 2010). La primera etapa del proceso de recuperación es llamada inflamación, y está mediada por la activación del complemento, los mastocitos y los neutrófilos, que forman parte de la primera línea de defensa del sistema inmune.

Tabla 1
Resumen de los artículos seleccionados.
Se caracteriza por la necrosis de las fibras dañadas, las cuales liberan su contenido al espacio extracelular incluyendo factores quimiotácticos que atraen a las células inflamatorias.
El sistema del complemento es el primer sensor del daño muscular, y se activa a los pocos segundos de ocurrida la lesión. Su activación permite la llegada de neutrófilos y macrófagos al daño (Frenette et al., 2000). Por otra parte, también se activan los mastocitos, cuya desgranulación es una de las respuestas más precoces del sistema inmune innato. Una vez activadas, los mastocitos liberan citoquinas inflamatorias, como el factor de necrosis tumoral α (TNF-α), interleuquina 1 (IL-1) e histamina, que a su vez reclutan a más mastocitos, neutrófilos y otras células inflamatorias (Yang et al., 2018). Finalmente, los neutrófilos son una de las células inflamatorias más importantes en etapas precoces después de una lesión. Al igual que los mastocitos, son activados en el músculo esquelético, liberando citoquinas inflamatorias como TNF-α, IFN-γ e IL-1β. Su activación es muy rápida, invadiendo las fibras dañadas dentro de las primeras 2 horas de ocurrido el daño. El número de neutrófilos llega a su máximo entre 6 y 24 horas después de la lesión y declina rápidamente entre 72 a 96 horas (Arango et al., 2014). Estos neutrófilos temporalmente empeoran el daño muscular y retrasan la siguiente etapa de la regeneración celular al liberar IL-1 y IL-8 que induce la llegada de macrófagos al sitio de la inflamación (Yang et al., 2018).
2) Segunda etapa. Proliferación
Se caracteriza por la activación y proliferación de las células satélite (stem cells) musculares, asociada a la llegada de macrófagos y linfocitos T. Las células satélite están encargadas de la regeneración de las células musculares. Se encuentran ubicadas dentro de la lámina basal rodeando las miofibras, justo entre la membrana basal del músculo y la lámina basal. Están presentes en todos los músculos esqueléticos y están asociadas a todo tipo de fibras musculares, pero no todas con igual distribución. Por ejemplo, el porcentaje de células satélite en el músculo sóleo adulto (fibras lentas) son dos a tres veces más abundantes que en el músculo tibial anterior (fibras rápidas). Por otra parte, su número va disminuyendo con el paso de los años, lo que explicaría que la capacidad regenerativa del músculo esquelético ante un daño se reduzca significativamente con la edad (Järvinen et al., 2005).
Los macrófagos son producidos en la médula ósea como monocitos, los cuales son reclutados por la acción de los neutrófilos. Empiezan a verse desde las 24 horas de producida la lesión incrementándose 2 días después, para luego descender rápidamente hasta el quinto día (Tidball, 2005). Los macrófagos juegan un rol primordial en la regulación de la regeneración muscular. Se pueden clasificar en dos grandes grupos: los macrófagos M1 activados, con un rol claramente inflamatorio, y los M2 también llamados “alternativamente activados”, que son antiinflamatorios (Mantovani et al., 2004). Los macrófagos M1 son los dominantes durante la inflamación, removiendo los restos celulares generados por el trauma, gracias a la liberación de citoquinas como TNF-α, IL-6 e IL-1β. El TNF-α tiene un importante rol en la regeneración muscular. Estudios en laboratorio con ratones sin esta citoquina o con el bloqueo de su receptor, mostraron severas alteraciones en la regeneración muscular (Chen et al., 2005). El TNF-α puede atraer células satélite al sitio de la lesión y promover su proliferación activando el factor nuclear de transcripción kappa β (NfKβ).
La IL-6 es producida por múltiples células inflamatorias, entre las que se encuentran los macrófagos y los linfocitos T. Se ha visto que es capaz de estimular la migración, proliferación y diferenciación de los mioblastos. En modelos animales, con sobreexpresión de la IL-6, se vio aumentada la activación de células satélite musculares. Por otra parte, la IL-1β es producida principalmente por macrófagos, favoreciendo la llegada de otros macrófagos y linfocitos T, estimulando la producción de IL-6 por las células musculares (Yang et al., 2018).
Los linfocitos T son la mayor población celular en ser reclutada en la segunda fase de la inflamación. Tanto las CD8+ como las CD4+ son atraídas por los macrófagos M1, apareciendo en el sitio de lesión al tercer día y permaneciendo hasta el décimo (Cheng et al., 2008). Similar a los macrófagos, los linfocitos T sintetizan una variedad de factores de crecimiento y citoquinas para modular el ambiente inflamatorio. Ratones con deficiencia de linfocitos T muestran alteración en el proceso de regeneración, mientras que al incorporarlos pueden recuperar el proceso regenerativo (Fu et al., 2015). Además, al aplicar péptidos secretados por linfocitos T humanos se acelera el proceso de regeneración, sugiriendo que estas citoquinas y factores de crecimiento secretados por los linfocitos T facilitan la regeneración muscular (Yang et al., 2018).
3) Tercera etapa. Remodelación
En esta etapa se desarrolla la diferenciación de las células satélite musculares y su maduración hasta formar nuevas miofibras. El ambiente proinflamatorio paulatinamente se convierte en uno de antiinflamatorio, lo cual se produce gracias al cambio de los macrófagos de M1 (proinflamatorio) a M2 (antiinflamatorio). Los macrófagos M2 producen citoquinas antiinflamatorias como las IL-4, IL-10 y IL-13. Además, los macrófagos M2 participan en las etapas tardías de la regeneración muscular. La ausencia de macrófagos M2 causa retraso en el crecimiento muscular e inhibe la diferenciación y regeneración del músculo.
Los linfocitos T reguladores son un tipo de linfocitos T. Su número es bajo durante las primeras fases de la inflamación, pero aumenta bruscamente en las etapas tardías (Fu et al., 2015). Estos linfocitos T reguladores secretan IL-10 y otras citoquinas para facilitar la conversión de macrófagos M1 a M2.
De manera paralela, en el sitio del hematoma se va formando paulatinamente una cicatriz de tejido conectivo por acción de fibroblastos, que tiene como objetivo formar un anclaje para las nuevas miofibrillas en formación. Los fibroblastos son células con un rol muy importante en la regeneración tisular, ya que proliferan en estrecha relación con las células satélite. La ausencia de fibroblastos conduce a una temprana diferenciación de la célula satélite evitando la formación de miofibrillas. Pese a que los fibroblastos son los responsables de la formación de la cicatriz fibrosa, la estimulación recíproca con las células satélite es muy importante para definir si se formará una nueva miofibrilla o se desarrollará una indeseada cicatriz de colágeno.
A) Cambios secundarios durante una lesión
El período de inactividad asociado a los mediadores inflamatorios existentes durante la lesión, genera otras consecuencias que si no son consideradas enlentecerán aún más el retorno a la competición y al nivel de juego existente previamente.
A.1 Atrofia muscular
Cuando el deportista tiene una lesión importante, en la mayoría de los casos se genera un período inicial de inmovilización o reducción de la actividad física, llamada “etapa de inmovilidad o atrofia”, que puede ir desde unos pocos días hasta varios meses. La inactividad puede ocasionar importantes pérdidas en la masa y fuerza musculares, lo que a su vez también altera la estructura y funcionamiento del tendón. Pérdidas significativas de masa muscular han sido descritas con solamente 5 días de inmovilización. Sin embargo, se han estudiado cambios en la expresión génica dentro de las primeras 48 horas de reposo. Estos cambios en la masa muscular se deben a un desequilibrio entre la síntesis de proteínas y su degradación. Estudios realizados con marcadores isotópicos muestran que tanto la degradación como la síntesis de proteínas están disminuidas después de 14 días de reposo estricto en cama, pero la síntesis afecta en una proporción mayor, generando este balance proteico negativo (Tipton, 2015).
A.2 Pérdida de la flexibilidad metabólica muscular
Se define flexibilidad metabólica como la capacidad del organismo para responder o adaptarse a las demandas energéticas o metabólicas en una situación determinada. Se la ha relacionado con la generación de resistencia a la insulina, obesidad y diabetes mellitus tipo 2 (Goodpaster y Sparks, 2017). La función oxidativa mitocondrial y la flexibilidad metabólica se ven afectadas durante las primeras semanas de reposo, al disminuir la transcripción proteica mitocondrial, disminución en las vías de señalización relacionadas con la biogénesis mitocondrial y un importante descenso en la actividad enzimática mitocondrial. Algunos de estos cambios ya son visibles a las 48 horas de iniciada la inactividad. Esta disfunción mitocondrial genera un menor transporte de glucosa por GLUT4 generando resistencia a la acción de la insulina (Tipton, 2015), lo que también impacta posteriormente en la acumulación de grasa corporal total.
A.3 Resistencia anabólica
Durante este período de reposo, asociado a la síntesis de mediadores inflamatorios que también se produce en esta etapa, se genera una “resistencia anabólica”, en la que se reduce la respuesta de la síntesis proteica muscular con los aminoácidos disponibles. Se postula que esta resistencia anabólica se podría producir por una digestión y absorción de aminoácidos enlentecida, alteración en la perfusión microvascular muscular que alteraría la incorporación de aminoácidos por el músculo y por un bloqueo en la señalización molecular anabólica intracelular (Glover et al., 2008).
A.4 Alteraciones óseas, tendinosas y ligamentosas
La inmovilización no solamente afecta a la célula muscular, sino también a todo el tejido de sostén que participa directa e indirectamente con el músculo. Durante la inmovilización disminuye la síntesis de colágeno por parte del tendón, cambiando sus propiedades mecánicas que son fundamentales para su funcionamiento (Tipton, 2010). Sin embargo, aún deben estudiarse los cambios que ocurren en el tejido conjuntivo que rodea la lesión.
A.5 Desregulación de las necesidades energéticas
Es evidente que, durante la etapa de inmovilización, al no existir entrenamiento ni competición, los requerimientos energéticos serán menores. Sin embargo, existen otros cambios en los requerimientos energéticos que deben considerarse. La misma cicatrización de la lesión muscular requerirá una demanda energética local mayor, debido a la necesidad de sintetizar nuevas proteínas para la recuperación. Este gasto de energía adicional puede aumentar entre un 15% hasta un 50% según el grado de inflamación, severidad, tamaño y duración de la lesión (Tipton, 2015). Por otra parte, si la lesión ocurre en las extremidades inferiores, existirán problemas para la deambulación, por lo que será necesario con cierta frecuencia usar bastones u órtesis con lo que sus requerimientos de energía para la deambulación pueden aumentar el doble (Tipton, 2015), por lo que nuevos requerimientos energéticos del deportista lesionado deben calcularse de manera personalizada, dependiendo del tipo de lesión y de su actividad diaria.
A.6 Respuesta psicológica y emocional
Cuando ocurre una lesión, el deportista no solamente presenta cambios físicos, sino también emocionales. El período de recuperación será un difícil momento de ansiedad y depresión, con la incertidumbre de no conocer exactamente cómo será el proceso de rehabilitación y las posibles consecuencias en su rendimiento al volver a competir. Son comunes las alteraciones alimentarias, que pueden ir desde un aumento de consumo de alimentos ricos en calorías como también en una restricción excesiva, ambos con consecuencias en su composición corporal. Un atleta con síntomas depresivos tendrá menos adherencia a las indicaciones nutricionales del equipo médico, por lo que idealmente sería importante trabajar junto a un psicólogo deportivo para cambiar la percepción del deportista frente a este período.
B) Intervención nutricional durante la lesión.
La primera intervención nutricional descrita en la literatura durante el período de inmovilización es evitar los déficits nutricionales de vitaminas, minerales y macronutrientes. El macronutriente que más afectaría a la recuperación de la lesión serían las proteínas provenientes de la dieta, ya que no solamente alteraría la síntesis de proteínas miofibrilares sino que también tendría un efecto directo sobre el metabolismo muscular. No existen estudios que hayan determinado la cantidad de proteínas necesarias para evitar la atrofia muscular específicamente durante el período de inactividad en lesiones de atletas. Estudios realizados en hombres por Tipton et al. mostraron que aportar altas dosis de proteínas (2.3 gramos de proteínas por kilo) disminuyó la pérdida de masa muscular en períodos de balance energético negativo comparado con atletas que recibieron 1 gramo de proteínas por kilo al día. Este estudio no se realizó en deportistas lesionados sino en períodos de pérdida de peso (Tipton, 2015). Se sabe qué en personas sanas activas, aportar 20 a 25 gramos de proteínas en una dosis maximiza la síntesis proteica y la resistencia anabólica, y la reducida actividad física hace pensar que sería necesario aportar una cantidad mayor. Esta ingesta mayor, que no se ha descrito hasta la fecha, debería distribuirse a lo largo de todo el día. En el caso de los aminoácidos esenciales, tampoco existen trabajos en lesiones deportivas.
La segunda intervención recomendada en la literatura es ajustar los requerimientos energéticos del deportista. Es evidente que el deportista lesionado, debido a su inactividad, gastará menos calorías al día que uno que entrena normalmente. Sin embargo, este ajuste no es tan simple ya que se deben considerar otros factores. La cicatrización y la síntesis de proteínas genera un aumento del gasto energético que puede aumentar hasta un 50% dependiendo del tipo y severidad de la lesión, siendo estimada hasta en unas 500 kcal en un hombre con una masa muscular importante (Tipton, 2015). Por otra parte, hay que considerar el gasto secundario a la deambulación: no será igual un atleta que debe permanecer en reposo completo en cama comparado con uno que requiera bastones, lo que demanda un gasto energético mayor. Pese al análisis anteriormente expuesto, lo más frecuente es que el deportista lesionado, debido a su inactividad física, empeore su composición corporal, aumentando su masa grasa tanto abdominal como de las extremidades. Se debe destacar que no solo es importante ajustar las calorías diarias totales, sino también la proporción de cada uno de los macronutrientes, disminuyendo los hidratos de carbono y aumentando proporcionalmente la ingesta de proteínas.
Finalmente, la tercera intervención es la utilización de suplementos alimenticios, tales como la proteína del suero de leche (Whey Protein), la creatina, el HMB y antiinflamatorios como la cúrcuma y el extracto de cereza ácida (tart cherry) entre otros. Hasta la fecha no existen trabajos utilizando estos suplementos en lesiones deportivas, pero si existe evidencia indirecta de su probable utilidad. La proteína de suero de leche y la cúrcuma han mostrado disminuir los marcadores inflamatorios como TNF-α, IL-1α y IL-1β (Derosa et al., 2016; Patel, 2015), por lo que podría ser utilizados como inmunomoduladores en las primeras etapas de la lesión muscular. Un estudio in vitro mostró que el tart cherry puede reducir la actividad de la COX-2 en un 38.3%, lo cual es equivalente al efecto de antiinflamatorios como el ibuprofeno o naproxeno (Bell et al., 2013). Por otra parte, se han encontrado en estudios in vitro receptores de vitamina D (VDR) en células satélite musculares, que son responsables de la regeneración muscular luego de una lesión (Braga et al., 2017).

Tabla 2
Evidencia de los principales suplementos nutricionales.
Si bien existe evidencia indirecta del uso de suplementos alimenticios para modular la inflamación muscular, se desconocen los posibles resultados durante una lesión, ya que se sabe que el proceso inflamatorio es vital para una adecuada regeneración tisular. Por ejemplo, la COX-2 mediante la PGE2 juega un rol en la proliferación de fibroblastos y es un potente regulador del TGF-β1, que a su vez participa en la síntesis de colágeno. Se ha visto además que bloquear el TNF-α también tiene efectos negativos en el proceso de recuperación, en especial en etapas tardías del proceso (Sass et al., 2018; Tidball, 2005). Por esta razón si lográramos saber el momento oportuno para disminuir la inflamación sin afectar la calidad del nuevo tejido, utilizando los suplementos y/o alimentos adecuados, podríamos modular mejor este proceso. Un ejemplo sería poder modificar la activación de macrófagos M1 hacia una respuesta antiinflamatoria mediada por macrófagos M2 en lesiones crónicas, con componentes presentes en la alimentación como la cúrcuma o el extracto de cereza ácida, lo que permitiría poder controlar la excesiva respuesta inflamatoria que aparece en ciertas lesiones.
Discusión
Actualmente existen pocas muestras publicadas sobre intervenciones nutricionales durante el período de una lesión. La gran mayoría de los estudios están desarrollados para favorecer la recuperación muscular o prevenir la osteopenia en adultos mayores, por lo que su aplicabilidad es indirecta. Se requieren más investigaciones realizadas en deportistas jóvenes con lesiones deportivas para aplicar mejor los resultados.
Una etapa clave en la recuperación de una lesión es la etapa inflamatoria, en la que múltiples mediadores inflamatorios, células del sistema inmunitario y componentes de la matriz extracelular interactúan para iniciar la reparación de los tejidos. Esta etapa podría modularse con alimentos antiinflamatorios para acortar el período de recuperación y de esta manera disminuir costos. Sin embargo, se sabe que el proceso inflamatorio es vital para una adecuada regeneración tisular. Por ejemplo, se ha visto que bloquear el TNF-α también tiene efectos negativos en el proceso de recuperación, en especial en etapas tardías del proceso (Sass et al., 2018; Tidball, 2005). Por esta razón, si se descubre el momento oportuno para disminuir la inflamación sin afectar a la calidad del nuevo tejido, utilizando los alimentos y/o suplementos adecuados, se podría modular mejor este proceso. Un ejemplo sería poder modificar la activación de macrófagos M1 hacia una respuesta antiinflamatoria mediada por macrófagos M2 en lesiones crónicas, con componentes presentes en la alimentación como la curcumina o el extracto de cereza ácida, entonces se podría controlar la excesiva respuesta inflamatoria que ocurre en ciertas lesiones (tabla 3).

Tabla 3
Resumen de los principales mediadores inflamatorios presentes en la recuperación de una lesión deportiva con su posible modulación nutricional, según datos actuales.
Un factor muy importante y que muchos deportistas olvidan, es que para volver a la competición en el menor tiempo y con el mayor nivel posible no solamente se debe modular la inflamación, sino que se debe evitar al máximo la atrofia muscular y la acumulación de tejido adiposo durante el período de recuperación. Mientras menos atrofia y menor aumento de grasa corporal se consigan, más rápido se logrará recuperar el nivel previo a la lesión. Bajar un excesivo porcentaje de grasa y fortalecer la musculatura puede demorar varias semanas e incluso meses, tiempo adicional que se agrega después del alta médica por una lesión prolongada. Para lograr estos objetivos es fundamental ajustar los requerimientos energéticos del deportista, disminuyendo el aporte de hidratos de carbono y aumentando las proteínas de la dieta para favorecer la recuperación. Este ajuste debe ser individualizado y adaptado a cada deportista. Una restricción calórica estricta puede reducir la síntesis proteica entre un 20 a 30% (Tipton, 2015), lo que altera la regeneración de los tejidos y empeorará la atrofia muscular. Es vital un control periódico para ajustar su pauta alimentaria a medida que el deportista aumente su actividad física.
En relación con el uso de suplementos, no existen estudios que evalúen directamente su uso en lesiones deportivas. Como ya se mencionó, es difícil obtener conclusiones válidas considerando lo heterogéneo que son las dosis, el tipo de pacientes y los protocolos de ejercicio realizados. Por otra parte, es difícil evaluar el impacto de un componente aislado de la dieta considerando lo complejo que es controlar el consumo de otros alimentos que pueden influir en los resultados. Se agrega a lo anterior que las variables medidas muchas veces son subjetivas, difíciles de cuantificar, como son el nivel de dolor o el grado de cicatrización de una herida. Los datos anteriores obligan a analizar cautelosamente los resultados de los estudios disponibles, sin sacar conclusiones definitivas e intentar aplicarlos con criterios determinados en cada caso hasta que aparezca nueva evidencia científica de mejor aplicabilidad.
Es importante hacer énfasis que la mejor intervención nutricional es privilegiar una adecuada alimentación, favoreciendo el consumo de frutas y verduras. En caso de necesitar incrementar el aporte diario de proteínas, se puede hacer aumentando su consumo desde los alimentos. En situaciones en que es difícil aportar altas cantidades desde la dieta, como es el caso de la cúrcuma, se pueden utilizar suplementos para obtener niveles plasmáticos adecuados de una manera más fácil y cómoda.
En los próximos años será necesario realizar nuevos trabajos, que estudien la relación de la alimentación con procesos inmunitarios y de inflamación sistémica. En el ámbito nutricional, deben abrirse nuevas líneas de investigación sobre lesiones deportivas para determinar que alimentos o suplementos estimulan a las células satélite musculares para regenerar el daño, modulan la respuesta inflamatoria favoreciendo la actividad antinflamatoria de los macrófagos M2, evitan la formación de una cicatriz fibrosa y evitan al máximo la atrofia muscular por inmovilidad. Aparte de su utilidad deben conocerse también las dosis adecuadas, el mejor momento para su administración y sus posibles efectos adversos.
Conclusiones
Considerando tanto la fisiopatología como los múltiples cambios tanto locales como secundarios después de una lesión deportiva, resulta necesario realizar una intervención nutricional personalizada en un atleta con una lesión de larga recuperación, dependiendo de la etapa de recuperación en la que se encuentre el deportista. Se deben ajustar los macronutrientes según los nuevos requerimientos energéticos de un deportista en recuperación, mediante una pauta alimentaria personalizada. De esta forma, se podría controlar el proceso inflamatorio, mejorar la calidad de la regeneración muscular, acortar tiempos de recuperación, reducir al mínimo la atrofia muscular y la acumulación de grasa abdominal, complementando el trabajo realizado por fisioterapeutas y readaptadores. Hasta la fecha no existe suficiente evidencia científica en el uso de alimentos y suplementos en lesiones deportivas. Se requieren más investigaciones y que se diseñen específicamente para este tipo de pacientes, para definir la alimentación y suplementación que son beneficiosas, las dosis adecuadas, el momento oportuno y la duración del tratamiento.
Referencias
[1] Abadi, A., Glover, E. I., Isfort, R. J., Raha, S., Safdar, A., Yasuda, N., et al. (2009). Limb Immobilization Induces a Coordinate Down-Regulation of Mitochondrial and Other Metabolic Pathways in Men and Women. PLoS ONE, 4(8), e6518–14. https://doi.org/10.1371/journal.pone.0006518
[2] Arango Duque, G., & Descoteaux, A. (2014). Macrophage cytokines: involvement in immunity and infectious diseases. Frontiers in Immunology, 5(11), 491. https://doi.org/10.3389/fimmu.2014.00491
[3] Bachl, N., Derman, W., Engebretsen, L., Goldspink, G., Kinzlbauer, M., Tschan, H., et al. (2009). Therapeutic use of growth factors in the musculoskeletal system in sports-related injuries. The Journal of Sports Medicine and Physical Fitness, 49(4), 346–357.
[4] Beaudart, C., Dawson, A., Shaw, S. C., Harvey, N. C., Kanis, J. A., Binkley, N., et al. (2017). Nutrition and physical activity in the prevention and treatment of sarcopenia: systematic review. Osteoporosis International, 28(6), 1–17. https://doi.org/10.1007/s00198-017-3980-9
[5] Beaudart, C., Rabenda, V., Simmons, M., Geerinck, A., de Carvalho, I. A., Reginster, J. Y., et al. (2018). Effects of Protein, Essential Amino Acids, B-Hydroxy B-Methylbutyrate, Creatine, Dehydroepiandrosterone and Fatty Acid Supplementation on Muscle Mass, Muscle Strength and Physical Performance in Older People Aged 60 Years and Over. A Systematic Review of the Literature. The Journal of Nutrition, Health & Aging, 22(1), 117–130. https://doi.org/10.1007/s12603-017-0934-z
[6] Bell, P. G., McHugh, M. P., Stevenson, E., & Howatson, G. (2013). The role of cherries in exercise and health. Scandinavian Journal of Medicine & Science in Sports, 24(3), 477–490. https://doi.org/10.1111/sms.12085
[7] Bell, P., Stevenson, E., Davison, G., & Howatson, G. (2016). The Effects of Montmorency Tart Cherry Concentrate Supplementation on Recovery Following Prolonged, Intermittent Exercise. Nutrients, 8(7), 441–11. https://doi.org/10.3390/nu8070441
[8] Braga, M., Simmons, Z., Norris, K. C., Ferrini, M. G., & Artaza, J. N. (2017). Vitamin D induces myogenic differentiation in skeletal muscle derived stem cells. Endocrine Connections, 6(3), 139–150. https://doi.org/10.1530/EC-17-0008
[9] Capó, X., Martorell, M., Sureda, A., Tur, J. A., & Pons, A. (2016). Effects of dietary Docosahexaenoic, training and acute exercise on lipid mediators. Journal of the International Society of Sports Nutrition, 13(1), 1–13. https://doi.org/10.1186/s12970-016-0126-y
[10] Chen, S.-E., Gerken, E., Zhang, Y., Zhan, M., Mohan, R. K., Li, A. S., et al. (2005). Role of TNF-α signaling in regeneration of cardiotoxin-injured muscle. American Journal of Physiology-Cell Physiology, 289(5), C1179–C1187. https://doi.org/10.1152/ajpcell.00062.2005
[11] Cheng, M., Nguyen, M.-H., Fantuzzi, G., & Koh, T. J. (2008). Endogenous interferon-γ is required for efficient skeletal muscle regeneration. American Journal of Physiology-Cell Physiology, 294(5), C1183–C1191. https://doi.org/10.1152/ajpcell.00568.2007
[12] Chevalley, T., Hoffmeyer, P., Bonjour, J.-P., & Rizzoli, R. (2010). Early serum IGF-I response to oral protein supplements in elderly women with a recent hip fracture. Clinical Nutrition, 29(1), 78–83. https://doi.org/10.1016/j.clnu.2009.07.003
[13] Close, G. L., Sale, C., Baar, K., & Bermon, S. (2019). Nutrition for the Prevention and Treatment of Injuries in Track and Field Athletes. International Journal of Sport Nutrition and Exercise Metabolism, 29(2), 189–197. https://doi.org/10.1123/ijsnem.2018-0290
[14] Colonetti, T., Grande, A. J., Milton, K., Foster, C., Alexandre, M. C. M., Uggioni, M. L. R., & Rosa, M. I. D. (2016). Effects of whey protein supplement in the elderly submitted to resistance training: systematic review and meta-analysis. International Journal of Food Sciences and Nutrition, 68(3), 257–264. https://doi.org/10.1080/09637486.2016.1232702
[15] Cooke, M. B., Rybalka, E., Stathis, C. G., Cribb, P. J., & Hayes, A. (2010). Whey protein isolate attenuates strength decline after eccentrically-induced muscle damage in healthy individuals. Journal of the International Society of Sports Nutrition, 7(1), 30–9. https://doi.org/10.1186/1550-2783-7-30
[16] Da Boit, M., Hunter, A. M., & Gray, S. R. (2017). Fit with good fat? The role of n-3 polyunsaturated fatty acids on exercise performance. Metabolism: Clinical and Experimental, 66, 45–54. https://doi.org/10.1016/j.metabol.2016.10.007
[17] Daily, J. W., Yang, M., & Park, S. (2016). Efficacy of Turmeric Extracts and Curcumin for Alleviating the Symptoms of Joint Arthritis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Journal of Medicinal Food, 19(8), 717–729. https://doi.org/10.1089/jmf.2016.3705
[18] Delfan, M., Ebrahim, K., Baesi, F., Mirakhori, Z., Ghalamfarsa, G., Bakhshaei, P., et al. (2015). The immunomodulatory effects of fish-oil supplementation in elite paddlers_ A pilot randomized double blind placebo-controlled trial. Prostaglandins Leukotrienes and Essential Fatty Acids, 99(C), 35–40. https://doi.org/10.1016/j.plefa.2015.04.011
[19] Derosa, G., Maffioli, P., Simental-Mendía, L. E., Bo, S., & Sahebkar, A. (2016). Effect of curcumin on circulating interleukin-6 concentrations: A systematic review and meta-analysis of randomized controlled trials. Pharmacological Research, 111, 394–404. https://doi.org/10.1016/j.phrs.2016.07.004
[20] Dreyer, H. C., Strycker, L. A., Senesac, H. A., Hocker, A. D., Smolkowski, K., Shah, S. N., & Jewett, B. A. (2013). Essential amino acid supplementation in patients following total knee arthroplasty. The Journal of Clinical Investigation, 123(11), 4654–4666. https://doi.org/10.1172/JCI70160
[21] Duan, Y., Li, F., Guo, Q., Wang, W., Zhang, L., Wen, C., et al. (2018). β-Hydroxy-β-methyl Butyrate Is More Potent Than Leucine in Inhibiting Starvation-Induced Protein Degradation in C2C12 Myotubes. Journal of Agricultural and Food Chemistry, 66(1), 170–176. https://doi.org/10.1021/acs.jafc.7b04841
[22] Duan, Y., Li, F., Li, Y., Tang, Y., Kong, X., Feng, Z., et al. (2015). The role of leucine and its metabolites in protein and energy metabolism. Amino Acids, 48(1), 41–51. https://doi.org/10.1007/s00726-015-2067-1
[23] Dupuy, O., Douzi, W., Theurot, D., Bosquet, L., & Dugué, B. (2018). An Evidence-Based Approach for Choosing Post-exercise Recovery Techniques to Reduce Markers of Muscle Damage, Soreness, Fatigue, and Inflammation: A Systematic Review With Meta-Analysis. Frontiers in Physiology, 9, 372–15. https://doi.org/10.3389/fphys.2018.00403
[24] Eijnde, B. O. ‘., Ursø, B., Richter, E. A., Greenhaff, P. L., & Hespel, P. (2001). Effect of Oral Creatine Supplementation on Human Muscle GLUT4 Protein Content After Immobilization. Diabetes…, 50(1), 18–23. https://doi.org/10.2337/diabetes.50.1.18
[25] Frenette, J., Cai, B., & Tidball, J. G. (2000). Complement Activation Promotes Muscle Inflammation during Modified Muscle Use. The American Journal of Pathology, 156(6), 2103–2110. https://doi.org/10.1016/S0002-9440(10)65081-X
[26] Fu, X., Xiao, J., Wei, Y., Li, S., Liu, Y., Yin, J., et al. (2015). Combination of inflammation-related cytokines promotes long-term muscle stem cell expansion. Nature Publishing Group, 25(6), 655–673. https://doi.org/10.1038/cr.2015.58
[27] Glover, E. I., Phillips, S. M., Oates, B. R., Tang, J. E., Tarnopolsky, M. A., Selby, A., et al. (2008). Immobilization induces anabolic resistance in human myofibrillar protein synthesis with low and high dose amino acid infusion. The Journal of Physiology, 586(24), 6049–6061. https://doi.org/10.1113/jphysiol.2008.160333
[28] Goodpaster, B. H., & Sparks, L. M. (2017). Metabolic Flexibility in Health and Disease. Cell Metabolism, 25(5), 1027–1036. https://doi.org/10.1016/j.cmet.2017.04.015
[29] Henrotin, Y., Priem, F., & Mobasheri, A. (2013). Curcumin: a new paradigm and therapeutic opportunity for the treatment of osteoarthritis: curcumin for osteoarthritis management. SpringerPlus, 2(1), 56. https://doi.org/10.1186/2193-1801-2-56
[30] Hespel, P., Op’t Eijnde, B., Van Leemputte, M., Ursø, B., Greenhaff, P. L., Labarque, V., et al. (2001). Oral creatine supplementation facilitates the rehabilitation of disuse atrophy and alters the expression of muscle myogenic factors in humans. The Journal of Physiology, 536(Pt 2), 625–633.
[31] Järvinen, T. A. H., Järvinen, T. L. N., Kääriäinen, M., Kalimo, H., & Järvinen, M. (2005). Muscle injuries: biology and treatment. The American Journal of Sports Medicine, 33(5), 745–764. https://doi.org/10.1177/0363546505274714
[32] Karimian, M. S., Matteo Pirro MD, P., Majeed, M., & Amirhossein Sahebkar PharmD, P. (2017). Curcumin as a natural regulator of monocyte chemoattractant protein-1. Cytokine and Growth Factor Reviews, 33, 55–63. doi:10.1016/j.cytogfr.2016.10.001
[33] Levers, K., Dalton, R., Galvan, E., O’Connor, A., Goodenough, C., Simbo, S., et al. (2016). Effects of powdered Montmorency tart cherry supplementation on acute endurance exercise performance in aerobically trained individuals. Journal of the International Society of Sports Nutrition, 1–24. https://doi.org/10.1186/s12970-016-0133-z
[34] Li, F., Yin, Y., Tan, B., Kong, X., & Wu, G. (2011). Leucine nutrition in animals and humans: mTOR signaling and beyond. Amino Acids, 41(5), 1185–1193. https://doi.org/10.1007/s00726-011-0983-2
[35] Liao, C.-D., Tsauo, J.-Y., Wu, Y.-T., Cheng, C.-P., Chen, H.-C., Huang, Y.-C., et al. (2017). Effects of protein supplementation combined with resistance exercise on body composition and physical function in older adults: a systematic review and meta-analysis. The American Journal of Clinical Nutrition, 106(4), 1078–1091. https://doi.org/10.3945/ajcn.116.143594
[36] Mantovani, A., Sica, A., Sozzani, S., Allavena, P., Vecchi, A., & Locati, M. (2004). The chemokine system in diverse forms of macrophage activation and polarization. Trends in Immunology, 25(12), 677–686. https://doi.org/10.1016/j.it.2004.09.015
[37] Medina, D., Lizarraga, A., & Drobnick, F.2014. (s.d.). Injury prevention and nutrition in football. Sports Science Exchange, 27, 1–5.
[38] Mehrabani, D., Seghatchian, J., & Acker, J. P. (2019). Platelet rich plasma in treatment of musculoskeletal pathologies. Transfusion and Apheresis Science, 58(6), 102675–11. https://doi.org/10.1016/j.transci.2019.102675
[39] Minshull, C., Biant, L. C., Ralston, S. H., & Gleeson, N. (2015). A Systematic Review of the Role of Vitamin D on Neuromuscular Remodelling Following Exercise and Injury. Calcified Tissue International, 98(5), 426–437. https://doi.org/10.1007/s00223-015-0099-x
[40] Patel, S. (2015). Functional food relevance of whey protein: A review of recent findings and scopes ahead. Journal of Functional Foods, 19(PA), 308–319. https://doi.org/10.1016/j.jff.2015.09.040
[41] Pierre, N., Appriou, Z., Gratas-Delamarche, A., & Derbré, F. (2016). From physical inactivity to immobilization: Dissecting the role of oxidative stress in skeletal muscle insulin resistance and atrophy. Free Radical Biology and Medicine, 98, 197–207. https://doi.org/10.1016/j.freeradbiomed.2015.12.028
[42] Sahebkar, A. (2013). Are Curcuminoids Effective C-Reactive Protein-Lowering Agents in Clinical Practice? Evidence from a Meta-Analysis. Phytotherapy Research, 28(5), 633–642. https://doi.org/10.1002/ptr.5045
[43] Sahebkar, A., Cicero, A. F. G., Simental-Mendía, L. E., Aggarwal, B. B., & Gupta, S. C. (2016). Curcumin downregulates human tumor necrosis factor-α levels: A systematic review and meta-analysis ofrandomized controlled trials. Pharmacological Research, 107, 234–242. https://doi.org/10.1016/j.phrs.2016.03.026
[44] Sass, F. A., Fuchs, M., Pumberger, M., Geissler, S., Duda, G. N., Perka, C., & Schmidt-Bleek, K. (2018). Immunology Guides Skeletal Muscle Regeneration. International Journal of Molecular Sciences, 19(3). https://doi.org/10.3390/ijms19030835
[45] Schneider, A., Hossain, I., VanderMolen, J., & Nicol, K. (2017). Comparison of remicade to curcumin for the treatment of Crohn’s disease_ A systematic review, 33, 32–38. https://doi.org/10.1016/j.ctim.2017.06.002
[46] Sousa, M., Teixeira, V. H., & Soares, J. (2013). Dietary strategies to recover from exercise-induced muscle damage. International Journal of Food Sciences and Nutrition, 65(2), 151–163. https://doi.org/10.3109/09637486.2013.849662
[47] Stöllberger, C., & Finsterer, J. (2019). Side effects of whole-body electro-myo-stimulation. Wiener Medizinische Wochenschrift (1946), 169(7-8), 173–180. https://doi.org/10.1007/s10354-018-0655-x
[48] Tidball, J. G. (2005). Inflammatory processes in muscle injury and repair. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 288(2), R345–R353. https://doi.org/10.1152/ajpregu.00454.2004
[49] Tipton, K. D. (2010). Nutrition for acute exercise-induced injuries. Annals of Nutrition and Metabolism, 57 Suppl 2(s2), 43–53. https://doi.org/10.1159/000322703
[50] Tipton, K. D. (2015). Nutritional Support for Exercise-Induced Injuries. Sports Medicine, 45 Suppl 1(S1), S93–104. https://doi.org/10.1007/s40279-015-0398-4
[51] Wall, B. T., Morton, J. P., & Van Loon, L. J. C. (2014). Strategies to maintain skeletal muscle mass in the injured athlete: Nutritional considerations and exercise mimetics. European Journal of Sport Science, 15(1), 53–62. https://doi.org/10.1080/17461391.2014.936326
[52] Wu, H., Xia, Y., Jiang, J., Du, H., Guo, X., Liu, X., et al. (2015). Effect of beta-hydroxy-beta-methylbutyrate supplementation on muscle loss in older adults: A systematic review and meta-analysis. Archives of Gerontology and Geriatrics, 61(2), 168–175. https://doi.org/10.1016/j.archger.2015.06.020
[53] Yang, W., & Hu, P. (2018). Skeletal muscle regeneration is modulated by inflammation. Journal of Orthopaedic Translation, 13, 1–8. https://doi.org/10.1016/j.jot.2018.01.002
[54] Yoneme, H., Hatakeyama, J., Danjo, A., Oida, H., Yoshinari, M., Aijima, R., et al. (2015). Milk basic protein supplementation enhances fracture healing in mice. Nutrition, 31(2), 399–405. https://doi.org/10.1016/j.nut.2014.08.008
ISSN: 2014-0983
Recibido: 10 de febrero de 2020
Aceptado: 5 de junio de 2020
Publicado: 1 de octubre de 2020
Editado por: © Generalitat de Catalunya Departament de la Presidència Institut Nacional d’Educació Física de Catalunya (INEFC)
© Copyright Generalitat de Catalunya (INEFC). Este artículo está disponible en la url https://www.revista-apunts.com/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


