Evaluación de la composición corporal y la bioimpedancia en corredores con síndrome de Down: apreciaciones derivadas de un estudio de cuatro casos
*Correspondencia: Marta Carrasco-Marginet mcarrascom@gencat.cat
Citación
Cebrián-Ponce, A., Irurtia, A., Garnacho-Castaño, M. V., Espasa-Labrador, J., Castizo-Olier, J., Sarola, J. & Carrasco-Marginet, M. (2024). Assessment of body composition and bioimpedance in runners with Down syndrome: insights derived from a four-case study. Apunts Educación Física y Deportes, 158, 1-10. https://doi.org/10.5672/apunts.2014-0983.es.(2024/4).158.01
Resumen
El síndrome de Down (SD) es un trastorno genético que conlleva una serie de problemas de salud, entre ellos, una reducción de la capacidad cardiorrespiratoria. En el caso de las personas con SD, resulta complicado conseguir una evaluación precisa de la composición corporal, debido a su singular morfología. Sin embargo, se trata de un componente crucial para la detección precoz de la obesidad y para el diseño de intervenciones específicas sobre los hábitos. Participaron en el estudio cuatro corredores varones con SD, que se sometieron a mediciones antropométricas y al análisis vectorial de impedancia bioeléctrica (modalidades clásica y específica) antes y después de completar la carrera de 14 kilómetros. Se emplearon varias ecuaciones para estimar la composición corporal. Asimismo, se hizo un análisis del somatotipo y se compararon los cambios bioeléctricos que provocó la carrera. Se reveló una variabilidad considerable en la composición corporal y el rendimiento en carrera de las personas con SD. Las diversas ecuaciones para estimar la masa grasa arrojaron resultados variables (del 4.2 al 33.3 %). En particular, se observó un patrón único en cada participante en cuanto a la cantidad de líquidos. El Participante 1 destacó con un ángulo de fase marcadamente alto (9.8°), mientras que los demás obtuvieron valores medios inferiores (4.5-6.3°). El análisis del vector de impedancia bioeléctrica indicó una pérdida normal de líquidos durante la carrera (T2 = 92.2; p < .0001). Resultó sorprendente que el Participante 1, el cual consiguió el menor tiempo de carrera, experimentase la pérdida de líquidos más significativa, pero mostrase una mayor retención de agua intracelular. Este estudio subraya la importancia de diseñar métodos de evaluación de la composición corporal adaptados a las personas con SD. El diseño de herramientas de evaluación precisas contribuirá a mejorar el bienestar de esta población en su búsqueda de estilos de vida activos. Estas conclusiones arrojan luz sobre la compleja relación entre composición corporal, hidratación y rendimiento en personas con SD.
Introducción
El síndrome de Down (SD) es el trastorno genético causante de discapacidad intelectual más frecuente en todo el mundo (Franceschi et al., 2019). El SD se asocia a una serie de problemas de salud que afectan en gran medida a la calidad de vida y a la capacidad cardiorrespiratoria de las personas afectadas (Seron et al., 2014). Estos retos se derivan de factores como las enfermedades cardiovasculares, la hipotonía muscular, la propensión al sobrepeso/obesidad, la baja masa ósea y el elevado índice de masa corporal (IMC), entre otros (Franceschi et al., 2019; Glasson et al., 2002). La predisposición a la obesidad en personas con SD se ve agravada por su estilo de vida, generalmente sedentario (Florentino Neto et al., 2010), debido principalmente a los complejos aspectos físicos y fisiológicos que conlleva esta afección. No obstante, la terapia a base de ejercicio ha mostrado resultados prometedores para la estandarización de la función autónoma y prevenir la aparición de enfermedades concomitantes (Cilhoroz et al., 2022). El uso de métodos adecuados de análisis de la composición corporal puede constituir una herramienta valiosa para la detección precoz de la obesidad que facilite el diseño de intervenciones específicas sobre los hábitos dirigidos a prevenir enfermedades crónicas.
Existen numerosas técnicas para evaluar la composición corporal, tales como la radioabsorciometría de doble energía (DXA), el análisis mediante bioimpedancia (BIA) y la cineantropometría, entre otras. Sin embargo, la composición corporal varía significativamente entre personas con y sin SD (González-Agüero et al., 2017). Esto supone un reto, ya que gran parte de los métodos utilizados para estimar el porcentaje de masa grasa (%MG) están concebidos para la población general (Nickerson et al., 2023). Esta incongruencia pone de manifiesto la necesidad de análisis adaptados a la singular morfología de las personas con SD, como proponen Rossato et al. (2018), en función de la suma de cuatro pliegues cutáneos (tríceps, subescapular, bíceps y suprailíaco), la edad, el IMC y el sexo. Más recientemente, Nickerson et al. (2023) introdujeron una nueva ecuación basada en los pliegues cutáneos medioaxilar y supraaxilar, derivada de una muestra de 20 participantes de distintas edades y sexos. La adopción de estos métodos de evaluación especializados podría mejorar la precisión de las mediciones de la composición corporal en personas con SD.
El análisis vectorial de la impedancia bioeléctrica (BIVA, por sus siglas en inglés) constituye una modalidad alternativa para evaluar la composición corporal. Este emplea el análisis cualitativo representando una matriz de los participantes dentro de elipses de población de referencia mediante el uso de parámetros bioeléctricos brutos, concretamente la resistencia (R) y la reactancia (Xc), junto con sus componentes derivados, la impedancia/longitud vectorial (Z) y el ángulo de fase (PhA) (Piccoli et al., 1994). El BIVA ofrece una solución a la posible imprecisión de las ecuaciones predictivas en poblaciones con características distintas, a través de la comparación de las posiciones vectoriales de los participantes con elipses de tolerancia que representan valores poblacionales de referencia; dicha solución requiere una elaboración mínima. Existen dos modalidades de BIVA, cada una adaptada a la estandarización de los parámetros bioeléctricos: el BIVA clásico, que se ajusta en función de la estatura (R/E, Xc/E, Z/E) para tener en cuenta la longitud del conductor y evaluar los líquidos corporales, y el BIVA específico, que se ajusta además en función de la estatura y las áreas transversales de los brazos, el tronco y las piernas (Resp, Xcesp, Zesp) con el fin de reducir la ponderación del volumen corporal y estimar el %MG (Campa et al., 2022a). En consecuencia, Z/E es inversamente proporcional al agua corporal total (Piccoli et al., 1994), mientras que Zesp es directamente proporcional al %MG (Toselli et al., 2020). PhA se considera un indicador de la salud celular y de la integridad de la membrana celular, inversamente proporcional a la relación entre agua extracelular e intracelular (ECW/ICW, por sus siglas en inglés), sea cual sea la modalidad del BIVA (Marini et al., 2020). Cabe destacar la gran carencia de estudios publicados sobre el BIVA en personas con SD, así como el escaso número de congresos sobre el tema.
Por ello, este estudio preliminar investiga las características morfológicas de una muestra de corredores con SD empleando métodos antropométricos y BIVA (clásico y específico). Asimismo, tiene por meta ofrecer una comparación inicial de los valores bioeléctricos con la población general, al tiempo que explora los posibles cambios bioeléctricos inducidos por una carrera de 14 km en personas con discapacidad intelectual.
Material y metodología
Participantes
En este estudio observacional y descriptivo, participaron cuatro varones con SD que eran corredores activos. Los participantes se inscribieron en la Volta a la Cerdanya Ultrafons® 2013, una carrera de 14 kilómetros con un desnivel de 489 metros. Estos fueron los criterios de inclusión en el estudio: (a) participantes de 18 años o más con SD y (b) ausencia de lesiones o afecciones clínicas en el momento del estudio. La competición estaba abierta a personas de ambos sexos, con y sin discapacidad. Sin embargo, entre los participantes con discapacidad solamente participaron varones.
El estudio se llevó a cabo de acuerdo con la Declaración de Helsinki. Todos los corredores participaron voluntariamente y otorgaron su consentimiento informado por escrito antes de su participación. El estudio recibió la aprobación previa del Comité de Ética del Consejo Catalán del Deporte (Aprobación n.º 0099 S/690/2013).
Procedimientos
Se realizaron mediciones antropométricas y bioeléctricas la mañana anterior a la carrera (PRE), en ayunas y después de que los participantes hubieran defecado y orinado. Una vez finalizada la carrera, y después de que los participantes se ducharan y secaran con toalla, se hicieron las mismas mediciones bioeléctricas (POST). Durante todas las mediciones, los participantes permanecieron sentados en una sala a temperatura constante y no se les permitió consumir alimentos ni bebidas. Inmediatamente después de terminar la carrera, los participantes indicaron su tasa de esfuerzo percibido (TEP) en una escala de diez puntos.
Antropometría
Las mediciones antropométricas siguieron los criterios estándares establecidos por la Sociedad Internacional para el Avance de la Cineantropometría (ISAK, por sus siglas en inglés) (Stewart et al., 2011). Se registraron las siguientes medidas: masa corporal (MC), medidas básicas (estatura, estatura en posición sedente y envergadura), nueve pliegues cutáneos (tríceps, subescapular, bíceps, pectoral, cresta ilíaca, supraespinal, abdominal, muslo anterior y pantorrilla medial), siete circunferencias (brazo relajado y flexionado, cintura, cadera, muslo medio, pantorrilla máxima y tobillo) y cuatro anchuras (húmero, muñeca, fémur y tobillo). Las mediciones fueron realizadas por un técnico de nivel 3 acreditado por la ISAK y registradas en milímetros en un modelo modificado de la ISAK. La estatura se midió con un tallímetro telescópico (Seca 220®, Birmingham, Reino Unido; rango de medición: 85-200 cm; precisión: 1 mm), mientras que la MC se midió con una báscula calibrada (Seca 710®, Birmingham, Reino Unido; capacidad: 200 kg; precisión: 50 g).
El grosor del pliegue cutáneo se midió en el lado derecho del cuerpo con un calibrador (Holtain Limited, Sussex, Reino Unido; rango: 0-80 mm, resolución: 0.20 mm, presión: 10 g/mm2, precisión: 99 %). Las circunferencias se midieron con una cinta métrica antropométrica flexible de acero (Lufkin Executive®, Lufkin, TX, EE. UU., precisión: 1 mm). Las anchuras se obtuvieron utilizando un paquímetro (Holtain Limited, Sussex, Reino Unido; precisión: 1 mm). Cada medición se realizó dos veces, y si las diferencias entre las mediciones de los pliegues cutáneos superaban el 5 %, o el 1 % en el caso de otras mediciones, se hacía una tercera medición. El valor final para el análisis de los datos fue la media de las dos mediciones o la mediana de las tres mediciones, según el caso.
El índice de masa corporal (IMC) se calculó como MC/E2 (kg/m2) y se clasificó como peso bajo (< 18.5 kg/m2), peso normal (18.5-24.9 kg/m2), sobrepeso (25-29.9 kg/m2) u obesidad (≥ 30 kg/m2). También se determinaron el índice de adiposidad corporal (IAC), en función de la relación entre el perímetro de la cadera y la estatura, y la masa grasa relativa (MGR), basada en la relación entre el perímetro de la cintura y la estatura. Las categorías del IAC incluían sano (8-21 %), con sobrepeso (21-26 %) y obeso (> 26 %), mientras que la MGR se clasificó como en forma (14-17 %), normal (18-24 %) y obeso (> 25 %). Los valores de corte de los índices diagnósticos de sobrepeso y obesidad de la relación cintura-cadera (RCC) y de la relación cintura-estatura (RCE) se situaron en 0.56 y 0.87, respectivamente. Para estimar el %MG, se calcularon las sumas de seis pliegues cutáneos (tríceps, subescapular, supraespinal, abdominal, medio muslo y máximo de la pantorrilla) y de ocho pliegues cutáneos (tríceps, subescapular, bíceps, cresta ilíaca, supraespinal, abdominal, medio muslo y máximo de la pantorrilla), y se utilizaron las ecuaciones de Durnin y Womersley (1974), Jackson y Pollock (1978) y Rossato et al. (2018). Se aplicó la ecuación de Siri (1993) para determinar la MG en las ecuaciones mencionadas en función de la densidad corporal.
Se empleó una selección de medidas antropométricas para determinar los componentes del somatotipo y trazar el somatotipo siguiendo el método de Carter y Heath (1990), en el que se define la forma y composición del cuerpo humano mediante tres cifras representadas por endomorfia, mesomorfia y ectomorfia.
Análisis de impedancia bioeléctrica
R y Xc se midieron con un analizador BIA 101 Anniversary Sport Edition (Akern Srl, Florencia, Italia), que emitía una corriente alterna sinusoidal de 400 μA a 50 kHz. Antes de las mediciones, se calibró el aparato con un circuito de impedancia conocida suministrado por el fabricante (R = 383 ± 10 Ω, Xc = 45 ± 5 Ω). Las variables bioeléctricas fueron obtenidas por examinadores cualificados, mediante la colocación estándar de electrodos pie-mano para hacer mediciones tetrapolares descrita por Kyle et al. (2004). Z se calculó como √(R2 + Xc2) y PhA se determinó como tan-1 (Xc/R · 180°/π). Para el BIVA clásico, R, Xc y Z se ajustaron según la estatura (R/E, Xc/E, Z/E), mientras que el BIVA específico incluía ajustes según la estatura y las áreas transversales del brazo, el tronco y la pierna (Resp, Xcesp, Zesp). Para estimar el %MG, se usó la ecuación de BIA propuesta por Kotler (1996).
Análisis estadístico
Los datos descriptivos se presentan como media ± desviación típica. Se utilizó una selección de medidas antropométricas para determinar los componentes del somatotipo siguiendo los métodos de Carter y Heath (1990), y se trazaron gráficos de puntos de los participantes para las modalidades clásica y específica, con referencia a una muestra de jóvenes italoespañoles sanos (Ibáñez et al., 2015). Los cambios en los valores bioeléctricos entre PRE y POST se calcularon como incrementos porcentuales (∆ %). Se emplearon gráficos RXc pareados y la prueba T2 de Hotelling de una muestra pareada para evaluar las diferencias entre los valores bioeléctricos PRE y POST. El nivel de significación se fijó en p < .05. El análisis de los datos se realizó mediante un programa informático SPSS (Chicago, IL, EE. UU., v. 21) y otro de BIVA (Piccoli y Pastori, 2002).
Resultados
En la Tabla 1, se presenta el perfil antropométrico completo de las cuatro personas con SD que participaron en el estudio, tanto individual como colectivamente. El rango de edad entre los participantes es claramente diverso, entre los 19 años del Participante 1 y los 42.9 del Participante 4. En otras mediciones básicas, se observan valores muy similares con pequeñas diferencias.
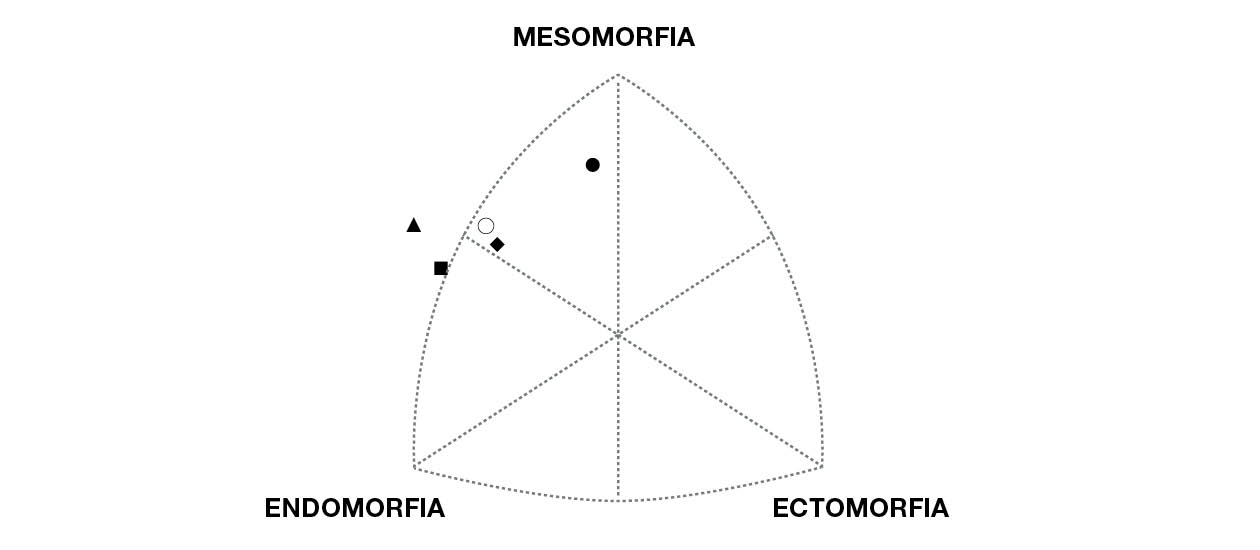
Sin embargo, el Participante 1 destaca con una suma de pliegues cutáneos significativamente inferior, tanto en la medición de seis pliegues cutáneos como en la de ocho. Cabe destacar la existencia de variaciones en el %MG calculado en varias ecuaciones. Los componentes del somatotipo más prevalentes entre los participantes son la mesomorfia (observada en todos los participantes) y la endomorfia (excepto en el participante 1), tal como se ilustra en la Figura 1.

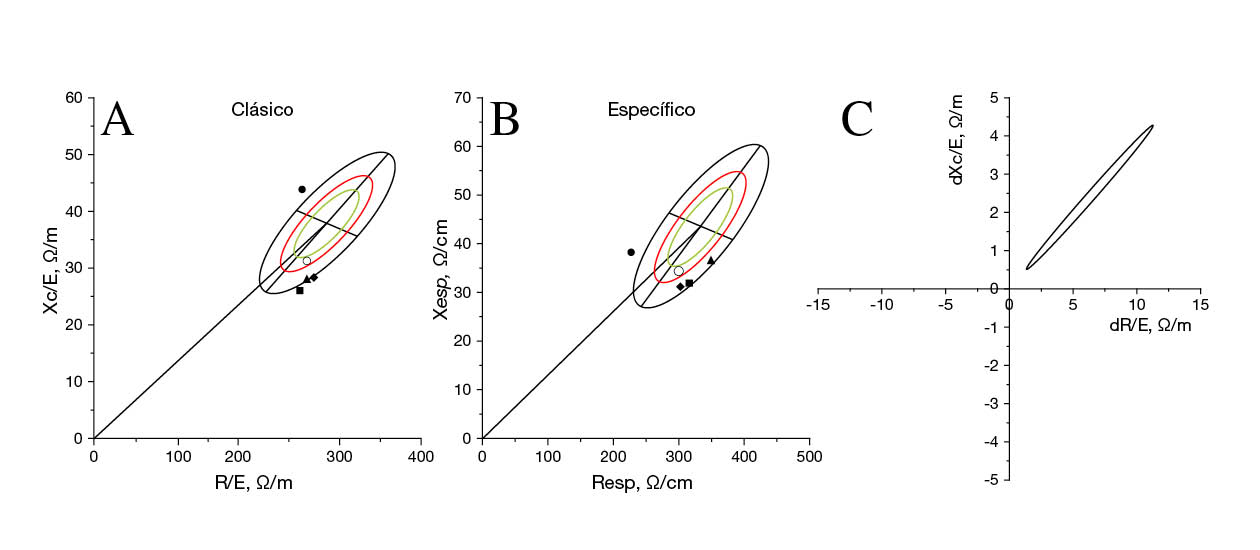
En la Tabla 2 se resumen los resultados de la carrera, junto con los valores bioeléctricos PRE y POST. Se observa una considerable discrepancia entre el tiempo de carrera del Participante 1 (99.5 minutos) y el del resto de participantes (170.8-208.5 minutos). Ninguno de los participantes se engloba dentro de la elipse de tolerancia clásica del 95 % ni de la elipse de tolerancia específica del 75 % respecto a la población italoespañola de referencia, tal y como se indica tanto en la modalidad clásica (Figura 2A) como en la específica (Figura 2B).

Tabla 2
Tiempo de carrera, TEP y características y cambios bioeléctricos producidos por la carrera de 14 km.
La alta intensidad de la carrera (7.8 ± 0.5 en una escala de TEP de 10 puntos) se refleja en una disminución de la masa corporal (MC) que oscila entre el 1.0 % y el 1.7 %, junto con una tendencia al alza de Z/E (de 2.1 % a 3.3 %) y de PhA (de 3.6 % a 6.3 %) en los cuatro participantes. Estos cambios tienen significación estadística, tal y como se demuestra en la Figura 2C (T2 = 92.2; p < .0001).
Discusión
El presente estudio ofrece un análisis exhaustivo de los perfiles morfológicos y los cambios bioeléctricos en personas con SD que participaron en una exigente carrera de montaña de 14 km. De este estudio se derivaron varias apreciaciones y observaciones de gran relevancia. Ante todo, es imperativo reconocer la importante variabilidad de las características antropométricas y bioeléctricas entre los cuatro participantes con SD. En concreto, el Participante 1 presentaba rasgos singulares, como una menor edad, una MG más baja y un PhA más alto. Hay que subrayar que el Participante 1 también consiguió el mejor tiempo de carrera por un margen considerable en comparación con los demás participantes. En segundo lugar, los métodos empleados para estimar el %MG mostraron disparidades considerables, lo que pone de manifiesto la importancia de emplear ecuaciones específicas para la población de personas con SD. Los valores bioeléctricos previos a la carrera se salían del rango normal en comparación con las personas sin discapacidad, pero todos ellos mostraron una tendencia normal de pérdida de líquidos, según indicaron los cambios bioeléctricos, lo cual constituye una respuesta habitual al ejercicio de resistencia.
Antes de profundizar en el análisis, es esencial tener en cuenta la variabilidad de edad entre los cuatro participantes, que oscila entre los 19 y los 42.9 años. Esta variación es especialmente relevante dado que el SD se asocia al envejecimiento prematuro, junto con el deterioro funcional y cognitivo (Bittles et al., 2007). Por lo tanto, no es de extrañar que tanto las medidas antropométricas como las bioeléctricas difirieran entre los participantes, especialmente en el Participante 1, ya que es considerablemente más joven que los demás.
Evaluación antropométrica
Nuestros participantes presentaban un IMC de 26.8 ± 2.6 kg/m2 (Tabla 1), valor muy similar al registrado en un estudio anterior con participación de adolescentes y jóvenes varones con SD (IMC medio: 26.1 ± 4.1 kg/m2) (Bandini et al., 2013). Cabe destacar la existencia de estudios recientes que han sugerido una relación inversa entre el IMC y la capacidad cardiorrespiratoria en adultos con SD (Bittles et al., 2007). El IMC es un indicador simple de la composición corporal que no evalúa directamente la adiposidad, pero se han diseñado varias ecuaciones en función de dicho indicador para estimar el %MG. Sin embargo, el estudio de Esco et al. (2016) reveló que estas ecuaciones son inadecuadas para las personas con SD, probablemente debido a la distinta distribución del tejido adiposo en esta población (Fedewa et al., 2019). Por consiguiente, es imprescindible disponer de ecuaciones específicas adaptadas a las personas con SD para realizar evaluaciones precisas.
En nuestro estudio, las diversas ecuaciones arrojaron resultados de %MG muy variables, y algunas ecuaciones produjeron valores poco realistas. A modo de ejemplo, mientras que el IMC englobó a los Participantes 1 y 4 en la categoría de peso normal y a los Participantes 2 y 3 en la de sobrepeso, tanto el IAC como la MGR clasificaron a todos los participantes como “obesos”. Por un lado, un estudio reciente indicó que el IAC podría no ser un parámetro adecuado al sobreestimar el %MG debido a la baja estatura de los participantes con SD (Fedewa et al., 2019; Rossato et al., 2017). Por otro, la MGR, a pesar de que también se base en la estatura, parece ofrecer una mayor precisión tanto para las personas con SD como para los que no lo tienen (Fedewa et al., 2019). Destaca el hecho de que el Participante 1, que tenía el menor tejido subcutáneo según las mediciones de los pliegues cutáneos, mostró un IAC y una MGR superiores a los del Participante 4 y similares a los del Participante 3. Por el contrario, la relación cintura-estatura (RCE) y la relación cintura-cadera (RCC) no clasificaron a ningún participante como obeso o con sobrepeso, excepto la MGR en el caso del Participante 3. Estas discrepancias entre los distintos métodos de evaluación ponen de manifiesto las dificultades para determinar con precisión el %MG y los riesgos para la salud que conlleva en las personas con SD.
Según lo ya comentado, las ecuaciones existentes para estimar la MG en función de los datos antropométricos de los pliegues cutáneos para la población general, como las de Durnin y Womersley y Jackson y Pollock, no son adecuadas para las personas con SD. En estas ecuaciones, hay una diferencia notable entre los 4 participantes, donde destaca de nuevo el Participante 1, que presenta un 10.4 % según Durmin y Womersley y un 4.2 % según Jackson y Pollock, lo que demuestra que estos valores no son correctos, especialmente en la segunda ecuación. González-Agüero et al. (2017) desarrollaron una ecuación de predicción para personas con SD dirigida específicamente a adolescentes de entre 12 y 18 años, por lo que esta ecuación podría no ser aplicable a los adultos. De ahí que Rossato et al. (2018) creasen una nueva ecuación para adultos de entre 18 y 47 años, así que se ajusta a nuestro grupo. No obstante, esta ecuación seguía dando lugar a variaciones significativas entre los participantes de nuestro estudio, donde el Participante 1 presenta una MG claramente inferior (6.6 %) a la de los demás (> 30 %). Nickerson et al. (2023), en un estudio reciente y viendo las limitaciones de las ecuaciones actuales, propusieron una nueva ecuación más completa, que no se pudo aplicar en este estudio porque carecíamos de los datos antropométricos necesarios. Además, se utilizó una ecuación de predicción basada en valores bioeléctricos (Kotler et al., 1996) que subestimó la MG de forma significativa (5.3-10.2 %). Esta infravaloración coincide con los resultados de estudios anteriores (Esco et al., 2017), aunque en nuestro estudio se utilizó un dispositivo diferente.
El análisis del somatotipo (Figura 1) reveló que el componente de mesomorfia predominaba en todos los participantes, lo que resultó sorprendente, dado que las personas con SD se caracterizan típicamente por una menor masa muscular (Artioli et al., 2017). El componente endomórfico fue el segundo con mayor prevalencia, considerablemente superior al ectomórfico, lo cual se ajusta más a las expectativas. La bibliografía relativa al somatotipo de los participantes con SD es casi nula y solamente se ha identificado un artículo de Bronks y Parker (1985). En dicho estudio, también hubo un predominio del componente endomórfico: el 62 % de los participantes fue clasificado como mesomórfico-endomórfico. Estos resultados invitan a una profunda revisión de este método para esta población específica.
Evaluación bioeléctrica
En el gráfico de puntos clásico (Figura 2A), el Participante 1 estaba situado en el cuadrante superior izquierdo de la población de referencia, mientras que los Participantes 2, 3 y 4 estaban situados en el cuadrante inferior derecho; sin embargo, ninguno de ellos estaba dentro de la elipse de tolerancia del 95 %. La interpretación de estos resultados sugiere que el agua corporal total de los corredores, indicada por Z/E, se encontraba principalmente dentro del rango normal. Sin embargo, y sorprendentemente, los valores de PhA presentaban reseñables alteraciones. Tal y como expone Sardinha (2018), es importante para la salud y el rendimiento deportivo tener un PhA más elevado, ya que esto indica una mejor función celular debido a su relación inversa con el ratio ECW/ICW. En cuanto a los valores bioeléctricos percentiles de referencia para deportistas desarrollados por Campa et al. (2022b), el valor de PhA del Participante 1 (9.8°) superaba el percentil 95 de los deportistas de resistencia, que se sitúa en 9.1°. Por tanto, era un PhA inusualmente alto. En cambio, los valores de PhA de los demás participantes se situaban muy por debajo del percentil 5 de los valores de referencia (6.3º). Si bien estos resultados concuerdan al comparar entre sí a personas con SD, parece menos lógico comparar al Participante 1 con la población general.
En el gráfico de puntos específicos (Figura 2B), todos los participantes aparecían en la mitad inferior de la elipse de tolerancia, lo que indicaba niveles inferiores de MG, y ninguno estaba dentro de la elipse de tolerancia del 75 %. Los resultados específicos del BIVA deben interpretarse con cautela debido a las características singulares del volumen corporal de las personas con SD; en este contexto, la estandarización de este planteamiento podría hacer que los valores sean menos adecuados. Es crucial tener en cuenta que se trata de personas activas que podrían tener una MG inferior a las de sus homólogos sedentarios, aunque no necesariamente menos MG que las personas sin SD.
Durante la carrera, los participantes experimentaron una ligera disminución de la MC de 1.4 ± 0.3 % (Tabla 2), acompañada de un aumento de las variables Z/E y de PhA en un 2.7 ± 0.6 % y un 5.8 ± 1.4 %, respectivamente. Estas alteraciones reflejan una notable pérdida de líquidos corporales, principalmente en el compartimento del agua extracelular, como se ilustra en la Figura 2C. A su vez, estos cambios entran dentro de lo esperado para las carreras de resistencia, en consonancia con los resultados de estudios anteriores (Castizo-Olier et al., 2018; Nescolarde et al., 2020). En particular, el Participante 1, que consiguió el menor tiempo de carrera, mostró el aumento más significativo de Z/E (3.3 %) pero el menor aumento de PhA (3.6 %), lo cual indica una mayor retención de agua intracelular. Esta observación es reseñable, ya que se sabe que el agua intracelular guarda relación con la potencia y la fuerza (Silva et al., 2014), por lo que podría contribuir al rendimiento superior del Participante 1.
Estudios futuros y limitaciones del presente estudio
Se sabe que el ejercicio físico influye positivamente en los perfiles de riesgo cardiometabólico, la fuerza muscular y la capacidad aeróbica tanto en la población general como en las personas con síndrome de Down (Paul et al., 2019). Por lo tanto, es esencial llevar a cabo evaluaciones adecuadas para mejorar la forma física y la salud en general, sobre todo en las personas con discapacidad, cuyos índices de sobrepeso y obesidad son notablemente superiores a los de la población general (Pitchford et al., 2018). Los estudios futuros deberían incluir muestras más amplias y variadas en cuanto a sexo y edad. Hasta entonces, los resultados de nuestro estudio son preliminares, sobre todo en el caso de los varones adultos activos con SD.
Es necesario constatar una serie de limitaciones. Faltan datos detallados sobre la condición física y los hábitos alimentarios de los participantes antes y durante el estudio. El reducido tamaño de la muestra (cuatro participantes), si bien no supone un reto logístico, limita la posibilidad de generalizar las conclusiones. Asimismo, la ausencia de un método de referencia para determinar la MG impide determinar de manera definitiva qué método de composición corporal refleja mejor la realidad. Los futuros estudios deberían tratar de abordar estas limitaciones y proporcionar una información más completa sobre la composición corporal y la salud en las personas con SD.
Conclusiones
El presente estudio aporta información valiosa sobre los perfiles morfológicos y los cambios bioeléctricos de las personas con SD tras una exigente carrera de 14 km. Las conclusiones resaltan la necesidad de emplear ecuaciones específicas para esta población con el fin de realizar evaluaciones precisas de la MG en personas con SD, así como la importancia de las modalidades estandarizadas para la valoración de los riesgos para la salud. El BIVA clásico indicaba un patrón normal de pérdida de agua debida a las exigencias físicas de la carrera.
Mientras las personas con SD siguen participando en actividades físicas y deportivas, es crucial realizar evaluaciones adecuadas para mejorar su forma física y su salud general. Los futuros estudios deberían ampliar estas conclusiones y abordar las limitaciones identificadas en el presente estudio para aportar una información más completa de la composición corporal y la salud en las personas con SD.
Agradecimientos
Los autores quisieran expresar su agradecimiento a todos los voluntarios. Con el apoyo del Instituto Nacional de Educación Física de Cataluña (INEFC) de la Generalitat de Catalunya.
Referencias
[1] Artioli, T. O., Witsmiszyn, E., Ferreira, A. B., & Pinto, C. F. (2017). Assessing Down syndrome BMI and body composition. International Medical Review on Down Syndrome, 21(2), 23-26. doi.org/10.1016/j.sdeng.2017.06.001
[2] Bandini, L. G., Fleming, R. K., Scampini, R., Gleason, J., & Must, A. (2013). Is body mass index (BMI) a useful measure of excess body fatness in adolescents and young adults with Down syndrome? Journal of Intellectual Disability Research, 57(11), 1050-1057. doi.org/10.1111/j.1365-2788.2012.01605.x
[3] Bittles, A. H., Bower, C., Hussain, R., & Glasson, E. J. (2007). The four ages of Down syndrome. European Journal of Public Health, 17(2), 221-225. doi.org/10.1093/eurpub/ckl103
[4] Bronks, R., & Parker, A. W. (1985). Anthropometric observation of adults with Down syndrome. American Journal of Mental Deficiency, 90(1), 110-113.
[5] Campa, F., Gobbo, L. A., Stagi, S., Cyrino, L. T., Toselli, S., Marini, E., & Coratella, G. (2022a). Bioelectrical impedance analysis versus reference methods in the assessment of body composition in athletes. European Journal of Applied Physiology, 122, 561-589. doi.org/10.1007/s00421-021-04879-y
[6] Campa, F., Thomas, D. M., Watts, K., Clark, N., Baller, D., Morin, T., Toselli, St., Koury, J. C., Melchiorri, G., Andreoli, A., Mascherini, G., Petri, C., Sardinha, L. B., & Silva, A. M. (2022b). Reference Percentiles for Bioelectrical Phase Angle in Athletes. Biology, 11(2), 264. doi.org/10.3390/biology11020264
[7] Carter, J. E. L., & Heath, B. H. (1990). Somatotyping: Development and Applications; Cambridge Studies in Biological and Evolutionary Anthropology. Cambridge University Press.
[8] Castizo-Olier, J., Carrasco-Marginet, M., Roy, A., Chaverri, D., Iglesias, X., Pérez-Chirinos, C., Rodríguez, F., & Irurtia, A. (2018). Bioelectrical impedance vector analysis (BIVA) and body mass changes in an ultra-endurance triathlon event. Journal of Sports Science and Medicine, 17(4), 571-579.
[9] Cilhoroz, B. T., Receno, C. N., Heffernan, K. S., & Deruisseau, L. R. (2022). Cardiovascular Physiology and Pathophysiology in Down Syndrome. Physiological Research, 71(1), 1-16. doi.org/10.33549/physiolres.934791
[10] Durnin, J. V, & Womersley, J. (1974). Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged from 16 to 72 years. The British Journal of Nutrition, 32(1), 77-97. doi.org/10.1079/bjn19740060
[11] Esco, M. R., Nickerson, B. S., Bicard, S. C., Russell, A. R., & Bishop, P. A. (2016). Agreement of BMI-based equations and DXA in determining body-fat percentage in adults with Down syndrome. Adapted Physical Activity Quarterly, 33(1), 89-96. doi.org/10.1123/APAQ.2014-0240
[12] Esco, M. R., Nickerson, B. S., & Russell, A. R. (2017). Comparison of bioelectrical impedance and DXA for measuring body composition among adults with Down syndrome. Disability and Health Journal, 10(4), 548-551. doi.org/10.1016/j.dhjo.2017.03.009
[13] Fedewa, M. V., Russell, A. R., Nickerson, B. S., Fedewa, M. P., Myrick, J. W., & Esco, M. R. (2019). Relative accuracy of body adiposity index and relative fat mass in participants with and without Down syndrome. European Journal of Clinical Nutrition, 73(8), 1117-1121. doi.org/10.1038/s41430-018-0351-3
[14] Florentino Neto, J., Pontes, L. M. de, & Fernandes Filho, J. (2010). Body compostion alterations resulting from weight training in subjects with Down Syndrome. Revista Brasileira de Medicina Do Esporte, 16(1), 09-12. doi.org/10.1590/s1517-86922010000100001
[15] Franceschi, C., Garagnani, P., Gensous, N., Bacalini, M. G., Conte, M., & Salvioli, S. (2019). Accelerated bio-cognitive aging in Down syndrome: State of the art and possible deceleration strategies. Aging Cell, 18(3), 1-11. doi.org/10.1111/acel.12903
[16] Glasson, E. J., Sullivan, S. G., Hussain, R., Petterson, B. A., Montgomery, P. D., & Bittles, A. H. (2002). The changing survival profile of people with Down’s syndrome: Implications for genetic counselling. Clinical Genetics, 62(5), 390-393. doi.org/10.1034/j.1399-0004.2002.620506.x
[17] González-Agüero, A., Matute-Llorente, Á., Gómez-Cabello, A., Vicente-Rodríguez, G., & Casajús, J. A. (2017). Percentage of body fat in adolescents with Down syndrome: Estimation from skinfolds. Disability and Health Journal, 10(1), 100-104. doi.org/10.1016/j.dhjo.2016.05.013
[18] Ibáñez, M. E., Mereu, E., Buffa, R., Gualdi-Russo, E., Zaccagni, L., Cossu, S., Rebato, E., & Marini, E. (2015). New Specific Bioelectrical Impedance Vector Reference Values for Assessing Body Composition in the Italian-Spanish Young Adult Population. American Journal of Human Biology, 27, 871-876. doi.org/10.1002/ajhb.22728
[19] Jackson, A. S., & Pollock, M. L. (1978). Generalized equations for predicting body density of men. British Journal of Nutrition, 40(3), 497-504. doi.org/10.1079/bjn19780152
[20] Kotler, D. P., Burastero, S., Wang, J., & Pierson Jr., N. R. (1996). Prediction of body cell mass, fat-free mass, and total body water with bioelectrical impedance analysis: Effects of race, sex, and disease. American Journal of Clinical Nutrition, 64(SUPPL.), 489S-497S.
[21] Kyle, U. G., Bosaeus, I., De Lorenzo, A. D., Deurenberg, P., Elia, M., Gómez, J. M., Heitmann, B. L., Kent-Smith, L., Melchior, J. C., Pirlich, M., Scharfetter, H., Schols, A. M. W. J., & Pichard, C. (2004). Bioelectrical impedance analysis - Part I: Review of principles and methods. Clinical Nutrition, 23(5), 1226-1243. doi.org/10.1016/j.clnu.2004.06.004
[22] Marini, E., Campa, F., Buffa, R., Stagi, S., Matias, C. N., Toselli, S., Sardinha, L. B., & Silva, A. M. (2020). Phase angle and bioelectrical impedance vector analysis in the evaluation of body composition in athletes. Clinical Nutrition, 39(2), 447-454. doi.org/10.1016/j.clnu.2019.02.016
[23] Nescolarde, L., Roca, E., Bogónez-Franco, P., Hernández-Hermoso, J., Bayes-Genis, A., & Ara, J. (2020). Relationship Between Bioimpedance Vector Displacement and Renal Function After a Marathon in Non-elite Runners. Frontiers in Physiology, 11(May), 1-13. doi.org/10.3389/fphys.2020.00352
[24] Nickerson, B. S., Esco, M. R., & Schaefer, G. (2023). Evaluation of Skinfold Techniques in People with Down Syndrome: Development of a New Equation. International Journal of Environmental Research and Public Health, 20(10). doi.org/10.3390/ijerph20105831
[25] Paul, Y., Ellapen, T. J., Barnard, M., Hammill, H. V., & Swanepoel, M. (2019). The health benefits of exercise therapy for patients with Down syndrome: A systematic review. African Journal of Disability, 8. doi.org/10.4102/ajod.v8i0.576
[26] Piccoli, A., & Pastori, G. (2002). BIVA SOFTWARE. In University of Padova (pp. 1-17).
[27] Piccoli, A., Rossi, B., Pillon, L., & Bucciante, G. (1994). A new method for monitoring body fluid variation by bioimpedance analysis: The RXc graph. Kidney International, 46(2), 534-539. doi.org/10.1038/ki.1994.305
[28] Pitchford, E. A., Adkins, C., Hasson, R. E., Hornyak, J. E., & Ulrich, D. A. (2018). Association between Physical Activity and Adiposity in Adolescents with Down Syndrome. Medicine and Science in Sports and Exercise, 50(4), 667-674. doi.org/10.1249/MSS.0000000000001502
[29] Rossato, M., Dellagrana, R. A., Da Costa, R. M., De Souza Bezerra, E., Otacílio Libardoni, J., & Rech, C. R. (2018). The Accuracy of Anthropometric Equations to Assess Body Fat in Adults with Down Syndrome. Journal of Applied Research in Intellectual Disabilities, 31(2), 193-199. doi.org/10.1111/jar.12290
[30] Rossato, M., Dellagrana, R. A., De Souza Bezerra, E., Da Costa, R. M., Dos Santos, J. O. L., Silva, D. A. S., & Diefenthaeler, F. (2017). Comparison of body adiposity index (BAI) and air displacement plethysmograph with estimations of % body fat in adults with Down’s syndrome. European Journal of Clinical Nutrition, 71(11), 1341-1344. doi.org/10.1038/ejcn.2017.18
[31] Sardinha, L. B. (2018). Physiology of exercise and phase angle: another look at BIA. European Journal of Clinical Nutrition, 72(9), 1323-1327. doi.org/10.1038/s41430-018-0215-x
[32] Seron, B. B., Silva, R. A. C., & Greguol, M. (2014). Effects of two programs of exercise on body composition of adolescents with Down syndrome. Revista Paulista de Pediatria, 32(1), 92-98. doi.org/10.1590/s0103-05822014000100015
[33] Silva, A. M., Matias, C. N., Santos, D. A., Rocha, P. M., Minderico, C. S., & Sardinha, L. B. (2014). Increases in intracellular water explain strength and power improvements over a season. International Journal of Sports Medicine, 35(13), 1101-1105. doi.org/10.1055/s-0034-1371839
[34] Siri, W. E. (1993). Body composition from fluid spaces and density: analysis of methods. 1961. Nutrition (Burbank, Los Angeles County, Calif.), 9(5), 480-491; discussion 480, 492.
[35] Stewart, A., Marfell-Jones, M., Olds, T., & de Ridder, H. (2011). International standards for anthropometric assessment. International Society for the Advancement of Kinanthropometry.
[36] Toselli, S., Marini, E., Latessa, P. M., Benedetti, L., & Campa, F. (2020). Maturity related differences in body composition assessed by classic and specific bioimpedance vector analysis among male elite youth soccer players. International Journal of Environmental Research and Public Health, 17(3). doi.org/10.3390/ijerph17030729
ISSN: 2014-0983
Recibido: 23 de enero de 2024
Aceptado: 22 de marzo de 2024
Publicado: 1 de octubre de 2024
Editado por: © Generalitat de Catalunya Departament de la Presidència Institut Nacional d’Educació Física de Catalunya (INEFC)
© Copyright Generalitat de Catalunya (INEFC). Este artículo está disponible en la url https://www.revista-apunts.com/ Este trabajo está bajo la licencia Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en la línea de crédito. Si el material no está incluido en la licencia Creative Commons, los usuarios deberán obtener el permiso del titular de la licencia para reproducir el material. Para ver una copia de esta licencia, visite https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_ES


